|
Faut-il encore avoir peur des nitrates ?
Christian BUSON
Télécharger le fichier au format Pdf
Faut-il encore avoir peur des nitrates ?
Christian BUSON
De nos jours, les nitrates font l'objet d'un consensus général. La réglementation sur l'eau potable, les programmes de " reconquête " de la qualité des eaux, les investissements prévus sur les ouvrages d'épuration, les mises aux normes des exploitations agricoles, tout est essentiellement conduit en vue d'un objectif suprême et apparemment incontesté : la baisse des taux de nitrates dans les milieux et, en particulier, dans l'eau. Il paraît utile, alors que des sommes considérables doivent encore être investies dans ce but, d'examiner, à la lumière des connaissances actuelles, le rôle exact de cet anion vis-à-vis de notre santé et de notre environnement, puis de tenter une synthèse à propos des nitrates.
Nitrates et santé
Les nitrates sont utilisés depuis des temps immémoriaux pour la conservation des aliments à des doses élevées : plusieurs grammes par kilo de viande ou de poisson à conserver.
Dans l'histoire, les nitrates ont été utilisés à fortes doses (supérieures à plusieurs grammes par jour) comme médicaments pour diverses affections (J. et J.L. L'hirondel, 1996). Aujourd'hui, de nombreux médicaments ont dans leur composition des sels nitratés ou des dérivés nitrés. Ainsi, la trinitrine est-elle très largement prescrite dans le traitement et la prévention de l'angine de poitrine ; de même, des gels dentaires contiennent du nitrate de potassium (à 5% de nitrate).
Les nitrates sont particulièrement et naturellement abondants dans la plupart des légumes (500 à 3 500 mg de NO3 par kilo de MS) et cela ne gêne en rien leur consommation. Celle-ci est vivement recommandée par tous les nutritionnistes et les études épidémiologiques confirment l'intérêt de la consommation régulière de légumes pour la protection sanitaire des populations contre diverses affections et, en particulier, pour prévenir et limiter les différentes formes de cancer. Si les nitrates présentaient la moindre toxicité, de tels résultats ne seraient pas observés avec les régimes à base de légumes.
Face à l'objection attribuant les effets bénéfiques des légumes à leurs seuls composés organiques, il serait facile de répondre que la consommation régulière de légumes éliminerait alors tous les risques supposés des nitrates.
Les nitrates ne sont généralement plus considérés comme toxiques en tant que tels - c'est l'éventuelle transformation des nitrates en nitrites puis leur combinaison avec les amines (nitrosamines) qui est en général mise en avant pour maintenir la suspicion à l'égard des nitrates.
Concernant la dangerosité des nitrites, nous pouvons apporter les arguments suivants (J. et J.L. L'hirondel, 1996) :
- La réduction des nitrates en nitrites est le résultat d'une transformation bactérienne qui dépend de plusieurs facteurs de milieu et qui nécessite du temps. Autrement dit, cette réduction s'effectue plus difficilement que la simple écriture de la réaction ne le laisserait supposer. En outre, les réactions se poursuivent au-delà du stade des nitrites, de sorte que l'accumulation de nitrites est relativement rare et que les concentrations en nitrites restent faibles dans les organismes.
- Les nitrites ne sont toxiques que pour le nourrisson avant 6 mois en raison de la moindre activité de la méthémoglobine-réductase. Les nitrites absorbés en grande quantité par le jeune nourrisson provoquent alors une affection particulière - la méthémoglobinémie - qui à partir d'un certain stade peut entraîner une cyanose. Cette affection a quasiment disparu dans les pays occidentaux. Passé cet âge de 6 mois, le nourrisson dispose d'un système enzymatique assez efficace pour faire face aux ingestions courantes de nitrites. Aucun effet des nitrites n'est plus à craindre après 6 mois, que ce soit par ingestion directe ou après transformation des nitrates (exogènes ou endogènes) en nitrites.
- Les nitrates ingérés par les nourrissons ne provoquent jamais de méthémoglobinémie, seule l'ingestion directe de nitrites préformés avant l'ingestion par le nourrisson est responsable de ce trouble. Dans l'organisme du nourrisson, la transformation des nitrates ingérés en nitrites est infime de telle sorte qu'aucun risque n'existe dans la consommation par le nourrisson d'aliments riches en nitrates tels que les soupes ou des préparations à base de légumes (carottes, épinards, etc.). La soupe de carottes est d'ailleurs abondamment consommée et même préconisée pour combattre ou prévenir des épisodes diarrhéiques des nourrissons.
- De simples mesures d'hygiène élémentaire suffisent à éviter les pullulations bactériennes à l'origine de toute transformation des nitrates en nitrites préalablement à l'ingestion par le jeune nourrisson. Il faut veiller en particulier à utiliser une eau indemne de contamination en agents pathogènes (après ébullition notamment), à nettoyer correctement les récipients et les ustensiles et, surtout, à réduire le délai entre la préparation et la consommation des aliments. Ainsi, la prévention de la méthémoglobinémie (affection rarissime aujourd'hui) portera essentiellement sur les conditions de préparation des aliments (hygiène, délais, etc.) et, en aucune manière, sur la teneur en nitrates de l'eau ou des ingrédients.
- Les nitrites ingérés par la mère ne sont pas dangereux pour le foetus car celui-ci est protégé par les enzymes maternelles. Il est donc inutile de recommander une quelconque modération de consommation de nitrites à la femme enceinte.
- Les nitrites sont aussi utilisés traditionnellement dans la conservation des viandes et des poissons. Leur usage est réglementé et autorisé jusqu'à plusieurs centaines de milligrammes par kilo de produit soumis à dessiccation. Les nitrites ne présentent aucun danger à ces doses modérées ni pour le nourrisson passé 6 mois, ni pour l'enfant, ni pour l'adulte, ni pour la femme enceinte, ni pour les personnes âgées, ni pour les personnes malades ou affaiblies. En tout état de cause, aucune ingestion de nitrates ne peut provoquer d'empoisonnement de l'organisme après transformation des nitrates en nitrites.
- Les nitrosamines éventuellement produites à partir des nitrates ingérés représentent des quantités infimes comparées aux quantités habituellement rencontrées dans de nombreux aliments ou dans notre environnement (J. et J.L. L'hirondel, 1996). Vouloir bannir les nitrates de notre alimentation au motif qu'une quantité infime est susceptible de former des nitrosamines est donc déraisonnable. L'élimination de toute trace de nitrosamine de notre environnement est absolument irréaliste et n'a d'ailleurs jamais été envisagée.
- Le risque de cancers induits par les nitrites et les nitrates n'a jamais pu être établi, bien au contraire, et peut être considéré comme négligeable.
En conséquence, les risques dus aux nitrates, par suite de leur éventuelle transformation en nitrites ou en nitrosamines dans l'organisme, peuvent donc être définitivement écartés.
Les nitrates ne provoquent que des effets bénéfiques pour la santé. Ils contribuent à la protection sanitaire par leur action à l'égard de nombreux agents pathogènes : bactéries, champignons, etc., (voir les travaux de l'équipe de N. Benjamin et al., 1994, 1995, 1996).
L'organisme utilise constamment les nitrates, qu'ils soient d'origine alimentaire (exogènes) ou endogènes. De plus, dans de nombreuses affections, l'organisme réagit en libérant une quantité accrue de nitrates. Le rôle essentiel joué par le monoxyde d'azote (NO) dans l'activité cellulaire explique cette présence de nitrates.
L'application des critères toxicologiques à l'égard des nitrates (J. et J.L. L'Hirondel, 1996), outre qu'elle est inappropriée s'agissant ici d'un composé non toxique, a été menée à l'origine à partir d'une publication imprécise de Lehman (1958) : une dose sans effet (DSE) a ainsi été évaluée sans vérification des effets de doses supérieures. C'est notamment ce que Maekawa a expérimenté en 1982 lorsqu'il a mis en évidence que des doses cinq fois plus élevées restaient également sans effet négatif pour leurs consommateurs. La dose maximale sans effet n'a pas été déterminée. Il en résulte que la dose journalière admissible (DJA) pourrait au moins être multipliée par cinq, et ainsi la norme sur l'eau potable qui est sensée en être déduite pourrait passer de 50 mg à 250 mg de NO3 par litre au minimum.
Pour conclure, ni les nitrates ni leurs dérivés dans l'organisme ne peuvent donc plus être considérés comme toxiques, à la lumière des connaissances scientifiques actuelles. Ainsi, Apfelbaum (1998) confirme que " la consommation de nitrates est inoffensive chez l'homme sans limite de dose ".
Nitrates, sol et plantes cultivées
Les nitrates constituent l'une des formes de l'azote, élément indispensable au développement de toute vie végétale et animale (Addiscott et al., 1991). Le cycle de l'azote dans le sol comprend normalement la forme nitrique (voir figure 1, Mariotti, 1996).
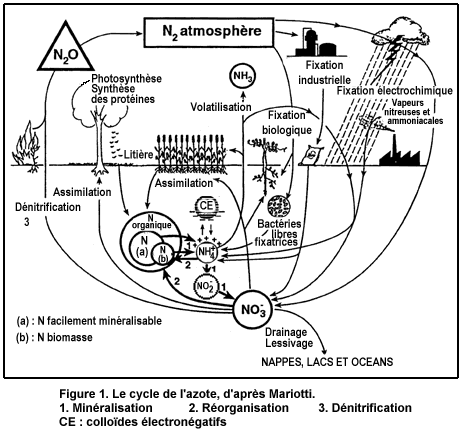
Les nitrates constituent la forme préférentiellement assimilée par les racines des végétaux terrestres et donc des cultures (Mengel et Kirby, 1982). L'azote nitrique nécessaire provient, pour l'essentiel, de la décomposition de formes organiques préexistantes.
L'assimilation des nitrates est indispensable à la croissance de toutes les familles de plantes à l'exception des papillonnacées. Pour ces dernières, la voie assimilative reste néanmoins active préférentiellement à la voie symbiotique (Drevon et Moyse,1990). La quantité libérée à partir de la minéralisation de la matière organique du sol est trop variable et limitée pour assurer une alimentation azotée correcte des cultures. Les rendements permis par l'azote minéral issu de la matière organique du sol sont restés historiquement faibles et aléatoires.
Le recours à une fertilisation azotée est incontournable : il faut garantir l'alimentation azotée des cultures permettant les rendements courants. De plus, il est nécessaire de maintenir la fertilité du sol et, en particulier, sa teneur en matière (et en azote) organique. Une fertilisation inférieure aux besoins des cultures contribuerait à limiter leurs rendements et à appauvrir progressivement les sols en matière organique.
L'activité microbienne du sol transforme l'azote organique et ammoniacal en nitrates. Ainsi, la solution du sol contient souvent et normalement des concentrations élevées en nitrates (100 à 250 mg de NO3 par litre). De telles concentrations sont utiles à l'alimentation des cultures. En culture hydroponique, les solutions nutritives utilisées dépassent souvent 500 mg de NO3 par litre (600 à1 200 mg/l selon Admont, 1991).
Les nitrates constituent la forme essentielle et naturelle de transfert d'azote du sol au milieu aquatique (Schlesinger, 1991). L'eau qui sourd du sol y acquiert sa composition chimique. Celle-ci comprend des teneurs variables mais élevées et souvent supérieures à 50 mg/l, notamment en phase de début de percolation. Lors du drainage hivernal, l'excès d'eau que le sol ne peut retenir, se mélange à la solution du sol et se charge des nitrates présents. Il est donc tout à fait logique que des concentrations élevées en nitrates soient mesurées lors des premières percolations. C'est ce qu'illustre la figure 2 tirée des travaux de J. Concaret et de Crecy (1974) ou le tableau 1 issu d'Arlot et Zimmer (1990).
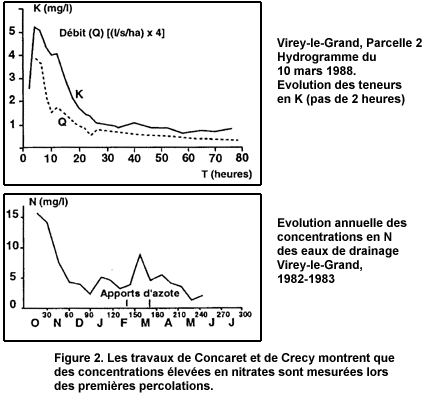
Les concentrations des eaux de drainage peuvent tendre vers les concentrations mesurables dans la solution du sol qui sont en général très supérieures à la norme de 50 mg de NO3 par litre. Cela n'est guère étonnant puisque cette norme a été établie sans prendre en compte la teneur en nitrates des milieux, mais uniquement au motif de précautions sanitaires.

La fertilisation doit être mesurée et limitée pour éviter tout excès d'azote inutile aux plantes et aux sols mais, quel que soit l'ajustement de la fertilisation, les concentrations en nitrates des eaux de drainage pourront dépasser, au moins lors de phases ponctuelles, le taux de 50 mg de NO3 par litre.
A titre d'illustration, il suffit de lixivier seulement 30 kg d'azote par hectare (ou 30 unités) pour que toute l'eau drainée sous nos climats présente une concentration moyenne de 50 mg de NO3 par litre. Cette masse d'azote d'une trentaine de kilos doit être comparée à la matière organique d'un sol qui contient plusieurs tonnes d'azote par hectare et à la mobilisation de la culture qui porte sur plusieurs centaines de kilos par hectare.
La fertilisation azotée la plus ajustée qu'il faut recommander et poursuivre pour des raisons agronomiques et économiques ne pourra garantir une teneur de l'eau constamment inférieure à 50 mg de NO3 par litre (in Lemaire.et Nicolardot, 1996). A plus forte raison , une agriculture biologique - fût-elle qualifiée de " durable " - qui ne quantifierait pas ses apports de fertilisants, en s'appuyant sur d'hypothétiques équilibres biologiques, ne pourra garantir une quantité des eaux conforme à la norme.
Nitrates et milieux aquatiques
Les nitrates ne présentent aucune toxicité pour la vie animale des milieux aquatiques. La forme ammoniacale, par contre, peut provoquer de graves intoxications lorsque la capacité d'oxydation du milieu est saturée et que le pH atteint des valeurs élevées propices à la forme non dissociée (NH3) très toxique (G. Barroin et al.,1996).
Les nitrates constituent un nutriment pour le phytoplancton. Toutefois, la forme ammoniacale est préférentiellement assimilée à la forme nitrique par ces organismes, contrairement aux macrophytes (G. Barroin et al.,1996).
Le fait que les nitrates constituent un nutriment n'implique en aucun cas qu'ils contribuent au développement intempestif de l'activité biologique et aux perturbations écologiques consécutives. La notion essentielle est celle du facteur limitant connue depuis Liebig sous le nom de " loi du minimum ". Il s'agit de l'élément (par nécessité le seul élément) qui, par son défaut dans la solution nutritive, limite le développement biologique. Or, compte tenu de sa faible concentration dans les milieux et de son importance dans toutes les réactions physiologiques (Westheimer, 1987), le phosphore constitue de manière systématique, parmi tous les nutriments, le facteur limitant, en particulier dans les milieux aquatiques. Un rapport N/P élevé (> 7 en masse d'éléments " biodisponibles ") doit être recherché pour limiter les effets indésirables d'un excès de phosphore (G. Barroin, 1989).
En l'absence de source azotée dans la solution, des cyanobactéries fixatrices d'azote prédominent. Ainsi, il est possible de considérer que l'azote, dans un milieu aquatique, ne fait jamais défaut puisque des mécanismes d'utilisation de l'azote atmosphérique se mettent en place en cas d'insuffisance de formes azotées en solution. L'azote atmosphérique, lui, n'est jamais limitant. Les nitrates présents dans les milieux aquatiques contribuent à éviter cette sélection de cyanobactéries fixatrices d'azote.
Les " excès de nitrates " subissent une dénitrification active avec rejet d'azote gazeux dans l'atmosphère et, ainsi, aucune accumulation de nitrates n'est observée dans les milieux aquatiques.
Un tel mécanisme de transfert vers l'atmosphère n'existe pas dans le cycle du phosphore. Il est possible de s'interroger sur les répercussions écologiques de l'accumulation de phosphore due aux rejets directs dans les milieux aquatiques consécutifs aux réseaux d'assainissement et à l'insuffisance du traitement du phosphore dans les stations d'épuration. Il est certain que les rejets de phosphore dans les milieux aquatiques se sont considérablement accrus depuis quelques dizaines d'années avec la généralisation des détergents phosphatés et des réseaux d'assainissement. La plupart des stations d'épuration ne disposent pas encore de norme de rejet en phosphore et le rôle essentiel joué par le phosphore dans les dystrophies des milieux aquatiques n'est clairement perçu dans la stratégie des Agences de l'eau et des services administratifs que depuis un petit nombre d'années.
Ainsi, les excès de phosphore contribuent-ils toujours à des désordres écologiques, entre autres quand les autres conditions sont réunies. Parmi celles-ci, la stagnation des eaux paraît essentielle de sorte que c'est surtout dans les milieux ralentis ou stagnants tels que les lacs, les estuaires, les marais et les zones marines côtières où l'effet de lagunage est prononcé, que le potentiel biogène du phosphore s'exprime. La présence de nitrates ne constitue en aucun cas une condition nécessaire à cette expression.
La dénitrification des nitrates présents ou apportés comme traitement peut contribuer à limiter les relargages de phosphore précipités avec des oxydes de fer ferrique. Les nitrates jouent un rôle d'agent oxydant limitant la réduction des sels de Fer à l'état ferreux et la remise en solution du phosphore biogène. Ainsi, des apports de nitrates au contact des sédiments dans une zone anoxique sont préconisés pour agir sur la restauration de plans d'eau eutrophes (Barroin, 1991 ; Ryding et Rast, 1994).
Le rôle essentiel du phosphore dans les eaux douces et la disculpation de l'azote et des nitrates en particulier ont été clairement démontrés par Schindler dès 1974. Ce sujet ne fait l'objet d'aucun débat chez les limnologues.
Concernant la question des écosystèmes estuariens et marins côtiers, le rôle de l'azote est souvent mis en avant, mais celui du phosphore reste central en tant que facteur limitant : sans sa présence en quantité suffisante, aucun développement biologique n'est possible. Comme en eau douce, le devenir des nitrates est soumis à la dénitrification et à l'assimilation : des micro-organismes capables d'utiliser l'azote gazeux d'origine atmosphérique (cyanophycées) pallient la carence du milieu marin en formes azotées solubles. Par contre, la dispersion vers le large constitue une voie particulière du devenir de l'azote marin. Aucune modification notable de la teneur en nitrates des eaux marines n'est constatée. Cette teneur reste faible.
Les apports de nitrates par les rivières et les fleuves ne contribuent en aucun cas à des désordres biologiques importants et systématiques. L'importance des apports de nitrates et de phosphates par les masses océaniques (upwellings) relativise souvent le rôle des apports terrigènes. Les apports de nitrates terrigènes semblent en général sans aucun effet notable sur les milieux estuariens et marins ; tout au plus sont-ils souvent évoqués comme nutriments pouvant contribuer aux désordres dont on ignore les causes et les mécanismes. Ainsi, il est fréquent que la notion de nutriment glisse insensiblement vers celles de l'" hyperfertilisation " puis de l'" eutrophisation " sans que la notion de facteur limitant ne soit utilisée pour étayer la moindre démonstration (Lacaze, 1996).
Les travaux menés dans la rade de Brest montrent également que le doublement estimé des flux de nitrates n'a pas entraîné d'augmentation des stocks phytoplanctoniques (Le Pape, 1996). Les auteurs soulignent et justifient que cette rade peut " supporter des apports massifs d'azote sans augmentation majeure de la biomasse phytoplanctonique ". L'azote ne se comporte donc pas comme le facteur limitant et ne pourra pas constituer le facteur de maîtrise.
Les tentatives de corrélations entre les développements d'ulves génératrices de " marées vertes " et les apports totaux de nitrates par les rivières se sont, jusqu'ici, soldées par des échecs. Cela revient à dire que les flux totaux de nitrates d'origine terrigène ne déterminent pas l'apparition de ce phénomène. Il y a indépendance entre les apports de nitrates et la prolifération algale. Les cartes ( Figure 3 ) établies par l'Ifremer illustrent parfaitement ce constat (Piriou, 1990). Ainsi, Merceron (1998) indique que malgré des apports azotés particulièrement faibles en 1997 (près de moitié inférieurs aux années précédentes), les biomasses observées et récoltées d'ulves n'ont pas connu d'évolution particulière à la baisse. Ceci interdit donc de conserver l'hypothèse des " nitrates-facteur limitant ". Parallèlement, de tels constats rendent caduque toute hypothèse considérant les nitrates comme un facteur de " maîtrise ".
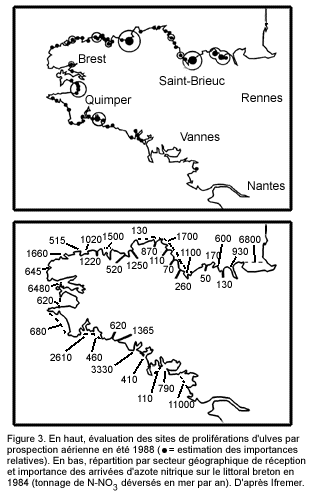
Seule la biomasse d'ulves produite, quand ces phénomènes existent (baie de Saint-Brieuc, par exemple), semble être corrélée aux apports nitriques d'origine terrigène du mois de juin uniquement (Piriou, 1990). Or les apports nitriques à cette période sont extrêmement faibles et leur niveau correspond à un bruit de fond dépendant de facteurs tels que les conditions climatiques et hydrologiques - facteurs non maîtrisables, à cette période, par les différents acteurs des bassins versants concernés.
En outre, ces résultats ont été observés dans un contexte où les niveaux de phosphore sont importants (Piriou et al., 1991) par suite de l'accumulation historique des apports en phosphore provenant des activités humaines et d'une dispersion insuffisante vers les milieux hauturiers, et cela en raison de conditions hydrodynamiques locales particulières.
D'autres travaux portant sur des régions diverses infirment ce rôle partiel des nitrates et privilégient celui des phosphates (Chiaudani et al., 1980 ; Berland et al., 1980 ; Smith, 1984 ; Hecky et Kilham, 1988 ; Vaulot et al., 1996 ; Philips et Badylack, 1996 ; X.Puente et al., 1996 ; Andrieux-Loyer, 1997).
L'utilisation des nitrates par les scientifiques et les experts
Les nitrates ont surtout été utilisés depuis quelques dizaines d'années comme traceurs ou indicateurs de la qualité du milieu ou de leur restauration par divers spécialistes appartenant à des disciplines scientifiques variées.
En réalité, si les nitrates constituent une forme azotée relativement facile à analyser, leur teneur n'indique rien d'autre que leur présence à cette concentration lors du prélèvement, sous réserve que les conditions de transport et de conservation entre le prélèvement et l'analyse n'aient pas perturbé les formes azotées.
Les microbiologistes ont longtemps utilisé les nitrates comme indicateur de souillures avec des effluents organiques (d'origine domestique ou animale) susceptibles par la présence de micro-organismes pathogènes de contaminer les populations. La présence de nitrate ne peut aujourd'hui être associée à ce risque. En effet, les effluents organiques contiennent à l'origine de l'azote uniquement sous forme réduite (protéique, uréique ou ammoniacale) ; autrement dit, les effluents infestés de germes peuvent à l'analyse ne contenir aucune trace de nitrates. La transformation en nitrate de cet azote réduit ne signifie également rien en terme microbiologique et sanitaire : la présence de nitrate est indépendante de l'état sanitaire du milieu.
Aucune corrélation n'a jamais été établie entre les nitrates et le moindre composé ou organisme indésirable du milieu. Une teneur en nitrate n'indique donc rien sur la présence de molécules autorisées en agropharmacie, ni sur la présence de micro-organismes pathogènes, ni sur la teneur en phosphore ou en éléments - traces métalliques ou organiques. Une teneur en nitrate ne renseigne donc pas sur l'état ou la qualité du milieu - l'agriculture " intensive " ne peut pas être appréciée ni caractérisée par cette teneur.
Lors de la définition des grilles de qualité des eaux, la valeur de 50 mg de NO3 par litre n'a été utilisée qu'au seul motif réglementaire, car des concentrations supérieures limitent l'usage des eaux superficielles. Il ne peut être en aucun cas affirmé ni démontré qu'un milieu sans nitrates serait possible et souhaitable. A plus forte raison, classer un milieu comme indemne de pollution parce que ne présentant qu'une infime concentration en nitrates serait erroné. Vouloir tendre vers des valeurs de NO3 faibles, proches des valeurs de référence dites " naturelles " (cf. Pourriot et Meybeck, 1995) , dans les eaux superficielles ne constitue pas un objectif pertinent.
L'utilisation de l'ion nitrate comme traceur est donc vaine. Curieusement, l'ubiquité de la forme nitrique ainsi que sa capacité de transformation auraient dû écarter toute idée d'utilisation de cet ion à ce propos.
Conclusion
En résumé, comme nous l'avons vu, les nitrates ne présentent aucune toxicité pour l'homme et leur limitation dans l'alimentation et dans l'eau potable ne repose plus sur aucune justification sanitaire sérieuse. Ainsi, Apfelbaum (1998) illustre-t-il avec les nitrates " le constat majeur de la dissociation entre la réalité telle que décrite par la science et les fantasmes collectifs créateurs d'une autre réalité, sociale puis politique. Pour les nitrates, le divorce est caricatural. Il est parfaitement démontré que la consommation d'une eau de boisson incomparablement plus riche en nitrates que la limite de potabilité légale serait inoffensive pour la santé ".
En outre, les normes actuelles constituent assurément un manquement au fameux principe de précaution puisque les nitrates, loin de présenter la moindre toxicité, ne possèdent que des effets bénéfiques établis et reconnus. Il est donc imprudent au plan sanitaire de préconiser une quelconque baisse des teneurs en nitrate de l'eau de boisson ou des aliments.
La difficulté majeure résiduelle consiste à trouver la méthode pour faire évoluer une norme établie et acceptée, mais devenue obsolète, à la lumière des connaissances scientifiques actuelles. Aucune procédure n'est prévue dans une telle situation ; le " principe de suspicion " paralyse toute tentative d'adaptation devenue nécessaire.
Les nitrates sont particulièrement utiles au développement des cultures et la forte limitation de la fertilisation azotée encouragée par une réglementation aux prétextes sanitaires aujourd'hui totalement réfutables ne pourra conduire qu'à la limitation des rendements et à une baisse de la fertilité des sols. Il n'est pas certain que cette évolution soit souhaitable en période de fort accroissement de la population mondiale et donc des besoins alimentaires.
Le devenir de l'azote nitrique ne provoque aucun effet négatif sur l'environnement : c'est le phosphore qui constitue toujours le facteur limitant de l'activité biologique dans les écosystèmes aquatiques. Ainsi, agir sur l'azote nitrique est un objectif quasiment vain mais surtout écologiquement inutile.
L'idée générale en biologie que l'azote et le phosphore sont des nutriments essentiels trop souvent associés sans discernement et à tout propos, a pu créer l'illusion d'un rôle analogue, voire alternatif, de ces deux éléments dans les désordres écologiques. De plus, azote et phosphore constituent la base des engrais minéraux abondamment utilisés en agriculture qui ont démontré leur efficacité pour accroître la production des cultures. L'idée que tout excès de nutriment peut nuire est tellement répandue que l'analogie supposée entre le rôle de l'azote et celui du phosphore s'en trouve renforcée. L'examen du rôle respectif de ces deux éléments, tel que nous venons de le résumer, aboutit au contraire à une disculpation de l'azote et à une responsabilité nette du phosphore.
L'erreur essentielle, en résumé, consiste à confondre un nutriment indispensable (mais disponible dans l'atmosphère) avec le facteur limitant des écosystèmes aquatiques.
La distinction entre le rôle de l'azote et celui du phosphore et de celle entre l'azote et ses différentes formes (nitrates, nitrites, ammoniaque, organique, azote gazeux) est déterminante de façon à ne pas poursuivre des objectifs erronés et inutiles.
L'omniprésence des nitrates dans de nombreux milieux a pu renforcer l'idée qu'ils avaient contaminé les milieux, alors que leur présence à des taux variables - jusqu'ici mal connus - est un fait banal et naturel. Aucune interprétation en terme de pollution par les nitrates n'est possible.
L'apparent consensus entre les différentes spécialités scientifiques et la répétition de la notion de pollution par les nitrates ne contribuent en aucun cas à en démontrer la pertinence et la justesse. Nous assistons plutôt à un curieux ballet où chacun utilise une notion qu'il croit établie dans une autre discipline sans qu'aucune de celles-ci ne l'ait jamais réellement démontré, ni vérifié. En outre, ceux qui savent ou qui doutent ne trouvent aucun avantage à bousculer un paradigme universellement reconnu et abondamment répété par les écologistes et les médias au point de constituer la pensée correcte du moment. Enfin, avec les nitrates, notre société avait peut-être trouvé l'ion idéal, matérialisant de façon caricaturale sa phobie de la chimie (Emsley, 1996).
Pourtant, étant donné que :
- les nitrates ne présentent pas de toxicité pour l'homme ou pour l'animal ;
- les seuls effets connus des nitrates peuvent être considérés comme bénéfiques, que ce soit dans la conservation des aliments, la protection sanitaire des populations ou le développement d'une production agricole de qualité, en quantité suffisante, sans perturber la fertilité des sols ;
- les nitrates ne perturbent pas les écosystèmes aquatiques et peuvent même contribuer à leur protection ;
- les nitrates ne constituent nullement un indicateur efficace de la qualité des milieux ;
on devra, tôt ou tard, abandonner définitivement la notion de pollution par les nitrates.
Les normes de protection ne devront être réservées qu'aux seuls composés dont les effets néfastes auront été correctement établis. En particulier, la recherche de réduction drastique de tout rejet de phosphore dans les milieux aquatiques doit enfin être considérée comme une priorité absolue.
Evidemment, pour l'économie générale et particulière ainsi que pour la crédibilité des messages justifiant les actions entreprises au nom de la protection de l'environnement, il serait souhaitable que la seule synthèse possible en ce qui concerne les nitrates soit comprise au plus vite. Il nous faudra admettre que des erreurs ont été commises, que les objectifs les plus pertinents (tel que l'absence de phosphore rejeté au milieu aquatique) n'ont été retenus que bien tardivement dans les stratégies de " lutte contre la pollution " et que l'on a curieusement mis en examen, puis condamné sans preuve, un ion pour lequel il faudra reconsidérer la normale présence, à des concentrations variables, dans les écosystèmes.
Après deux décennies de discours, de sensibilisation et d'intentions de programmes d'actions visant à éliminer les nitrates des milieux aquatiques, cette évolution paraîtra surprenante à un grand nombre d'acteurs, freinant ainsi l'inéluctable réhabilitation des nitrates. Il nous semble toutefois, avec Thomas Mann, " qu'une vérité qui dérange est toujours préférable à un mensonge qui fait du bien " - ce dernier fut-il entretenu sous de fumeux prétextes de stratégie ou de communication environnementale.
Références
T.M Addiscott, A.P Whitmore et D.S. Poulson, 1991, Farming and the Nitrate Problem, CAB international, 170 p.
Paul-Henri Admont, 1991, Les nitrates, déchet de notre société de consommation ou produit biologique naturel ?, 63p.
Françoise Andrieux-Loyer, 1997, Les formes de phosphore particulaire et sédimentaire en environnement côtier. Méthodes d'analyse, biodisponobilité, échange, Thèse de doctorat, université de Bretagne occidentale, Brest.
Marian Apfelbaum, 1998, Risques et peurs alimentaires, éditions Odile Jacob, 284 p.
M.P. Arlot, D. Zimmer, 1990, Drainage agricole et lessivage des nitrates, Symposium Nitrates, agriculture, eau. INRA éditions.
Guy Barroin, 1989, La pollution des eaux stagnantes par les phosphates : controverses (pseudo) scientifiques et (absence de) décisions politiques. Arc et senans, Colloque international : les experts sont formels.
Guy Barroin, J.M. Dorioz, P. Durand, P. Mérot, 1996, " Entraînement de l'azote dans les eaux de surface et conséquences sur les écosystèmes aquatiques ", Colloque INRA : maîtrise de l'azote dans les agrosystèmes.
Guy Barroin, 1991, La pollution par les phosphates, Ademart, station d'hydrobiologie lacustre INRA Thonon-les-Bains, 15 p.
B.R. Berland, D.J. Bonin, S.Y. Maestrini, 1980, " Azote ou phosphore ? Considérations sur le "paradoxe nutritionnel" de la mer méditerrannée ", Oceanologica acta, 1980, Vol. 3, N°1, pp. 135 à 142.
N. Benjamin, F. O' Driscoll, H. Dougall, C. Dunacan, L. Smith, M. Golden, H. Mac Kenzie, 1994, " Stomach NO synthesis ", Nature, 368, 502.
N. Benjamin, C. Duncan, H.T. Dougall, P. Johnston, S. Grenn, R. Brogan, C. Leifert, L. Smith, R. Golden, 1995, " Chemical generation of nitric oxide in the mouth from the enterosalivary circulation of dietary nitrate ", Nature medecine, pp. 546-551.
N. Benjamin, R. Sdkyhuizen, M. Copland, C.C. Smith, G. Douglas, 1996, " Antimicrobial effect of acidified nitrite on gut pathogens : importance of dietary nitrate in host defense ", Antimicrob. Agents Chemother, 40, pp. 1422-25.
G. Chiaudani, R. Marchetti, M. Vighi, 1980, " Eutophication in emilia-romagna coasal waters (north adriaric sea, Italy ) : a case study ", Prog. Wat. Tech., Vol. 12, N°1, pp.185-192.
J. Concaret et J. de Crecy, 1989, " Composition des eaux de drainage, résultats expérimentaux ", Soil technology, Vol. 2, pp.185-203.
J.J. Drevon et A. Moyse, 1990, Energétique comparée de l'assimilation des nitrates et de l'azote moléculaire per les légumineuses, C. R. Acad. Agric., pp. 89 à 96).
John Emsley, 1996, Guide des produits chimiques à l'usage des particuliers, Editions Odile Jacob, 336 p.
R.E. Hecky et P. Kilham, 1988, " Nutrient limitation of phytoplankton.in freshwater and marine environment : a review and of recent evidences of enrichments limnol ", Oceanograph, 33 (4, part 2), pp. 796-822.
Jean-Claude Lacaze, 1996, L'eutrophisation des eaux marines et continentales, Ellipses, 192 p.
G. Lemaire et B. Nicolardot,1996, Maîtrise de l'azote dans les agrosystèmes, Colloque INRA , INRA éditions, 333 p.
Olivier Le Pape, 1996, Modélisation des cycles biogéochimiques des éléments limitant la production phytoplanctonique en rade de Brest, Thèse de l'ENSAR Rennes.
Jean et Jean-Louis L'hirondel, 1996, Les nitrates et l'homme. Le mythe de leur toxicité, Editions de l'institut de l'environnement, 142 p.
André Mariotti, 1996, Quelques réflexions sur le cycle biogéochimique de l'azote dans les agrosystèmes, Colloque INRA : maîtrise de l'azote dans les agrosystèmes, INRA éditions, pp. 9 à 24.
Konrad Mengel et Ernest A. Kirby, Principles of plant nutrition, 1982, 3ème édition, International Potash Institute Bern, 665 p.
Michel Merceron, 1998, Inventaire des ulves en Bretagne-année 1997, rapport de synthèse, Ifremer-Agence de l'Eau Loire-Bretagne 18 p.+ annexes.
E.J. Phlips et S. Badylak, 1996, " Spatial variability in phytoplancton standing crop and composition in a shallow inner-shelf lagoon ", Florida Bay, Florida Bull. Mar. Sci., Vol. 58, N°1, pp..203 à 216.
J.Y. Piriou, 1990, Marées vertes littorales et nitrates, Symposium international Nitrates-agriculture-eau, R. Calvet, INRA éditions.
J.Y. Piriou, A. Menesguen, J.C. Salomon, " Les marées vertes à ulves : conditions nécessaires, évolution et comparaison des sites ", 1991. In Estuaires and coasts : spatial and temporal intercomparisons. ELSA symposium.
R.Pourriot et M.Meybeck, 1995, Limnologie générale, Masson, 956 p.
X. Puente, R. Villares, E Carral, A. Carballera, 1996, " Macroalgal pptoliferation (ullva "bloom") along a pattern of eutrophication coastal areas of galicia (NW Spain) ", Premier colloque interceltique d'hydrologie et de gestion des eaux, Bretagne 96, édition INSA.
O. Ryding et W. Rast 1994, Le contrôle de l'eutrophisation des lacs et des réservoirs, Unesco, Masson, 294 p.
D.W. Schindler, 1974, " Eutrophication and Recovery in Experimental lakes : Implication for lake management ", Science du sol, Vol. 184, pp. 897 à 899.
D.W. Schindler, 1977, " Evolution of phosphorus limitation in lakes. Natural mechanisms compensate for deficiences of nitrogen and carbon in eutrophied lakes ", Science du sol, Vol. 195, pp. 260 à 262.
William Schlesinger, 1991, Biogeochemistry an analysis of global change, Academic press. inc., 445 p.
S.V. Smith, 1984, " Phophorus versus nitrogen limitation in the marine environment ", Limnology and oceanography, Vol 29 -6, pp. 1149 à 1160.
D. Vaulot, N. Lebot, D. Marie, E. Fukai, 1996, " Effect of phosphorus on the Synechococcus cell in surface Mediterranean waters during summer ", Appl. Environ. Microbiol., Vol.63, N°7, pp. 2527 à 2533.
F.H. Westheimer, 1987, " Why nature chose phosphates ", Science, Vol. 235, pp. 1173 à 1117.
|