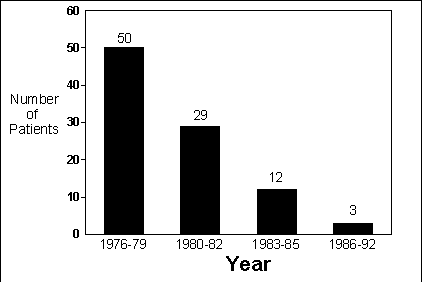Accueil d'Ouverture
des Journées
Docteur Patrick TOUBON : Président QUALIBIO
Professeur Edmond-Antoine DECAMPS : Université
de Rennes
|
|
Le contenu
des communications présentées n'engage que les auteurs. Les
traductions sont indicatives afin de permettre une compréhension
globale du sujet.
|
|
Mesdames,
Messieurs,
C'est
un grand honneur de pouvoir vous accueillir, au nom de tous les membres des
Comités, pour les Assises Internationales ENVIROBIO.
La
préparation de ce colloque résulte d’une synergie de volontés et de compétences
souhaitant mobiliser techniques et savoir, et constitue le fruit d'une collaboration
pluridisciplinaire forte.
De par notre indépendance, nous souhaitons développer à travers ce colloque :
Ø Un objectif fédérateur :
·
rapprochant les instances
institutionnelles nationales et internationales,
·
regroupant largement
les représentants des divers milieux professionnels de la santé, de l'environnement
et de l'agriculture,
·
associant une réflexion
entre l'enseignement, la recherche et tous ses domaines d’application.
Ø Un objectif stratégique
et méthodologique :
·
par une approche globale
et transdisciplinaire de la qualité et de la gestion des risques dans tous
ses aspects :
-
Cliniques, toxicologiques
-
Epidémiologiques
-
Ecologiques
-
Réglementaires et juridiques
-
Techniques
-
Economiques
-
Qualité et Responsabilité
-
Institutionnels
-
Opinion publique
·
par le rassemblement et la confrontation des
connaissances, y compris sur des thèmes controversés, pour permettre, dans
la meilleure impartialité les débats et les synthèses, dans l’état actuel
des connaissances scientifiques.
Dans ce contexte, une réflexion pluridisciplinaire
approfondie, s'appuyant sur les publications des spécialistes internationaux
et sur des débats contradictoires, sur le thème des nitrates, est apparue
judicieuse : c’est l’objet central de ce colloque : permettre la confrontation
des différents points de vue scientifiques et l'appréciation du thème dans
toute sa pluridisciplinarité.
Ensuite,
pour arrêter
ses choix, le monde politique doit disposer des synthèses les plus justes
et les mieux étayées et prévoir leur réactualisation pour une meilleure appréhension
des choix concernant la sécurité sanitaire. C’est l’ambition de ce colloque
avant tout scientifique de préparer à la synthèse indispensable pour la prise
de décision par les structures qui en ont la charge, en toute connaissance
de cause.
Ce colloque fait suite notamment au colloque
Managing risks of nitrates to humans ant the environment
organisé en septembre 1997 par The Royal Society of Chemistry à l’Université
d’Essex (U.K.).
Bien
évidemment, tous les aspects ne pourront être traités ici de façon exhaustive,
et d’autres journées comme celles-ci suivront et permettront de compléter
notre réflexion.
Parce
qu’il est essentiel pour notre société d’apprendre à discerner les risques
réels des risques supposés, nous souhaitons que ces journées constituent un
outil de travail et d'information servant de référence pour toutes les applications
concernées.
Une
dynamique existe ... continuons
à la consolider
Construisons ensemble la Qualité et la pertinence des informations
Christian BUSON
Patrick TOUBON
ISTE
AACCES QUALIBIO
ALLOCUTIONS D'OUVERTURE
Représentant
du Sénat :
Monsieur Philippe
NOGRIX – Sénateur d'Ille-et-Vilaine
Conseiller
Général
Positionnement
des Assises
Professeur Maurice
TUBIANA – Académie des Sciences
La France est,
depuis quinze ans, périodiquement balayée par des vagues de peurs sanitaires
à propos de la dioxine, des pics de pollution atmosphérique, de la contamination
radioactive de champignons ou de sangliers, des leucémies autour de la Hague,
de la pollution d'origine agricole, des nitrates dans l'eau de boisson ou
les rivières, et bien entendu de l'affaire de la vache folle.
Même quand la
majorité Cles scientifiques considèrent ces risques comme faibles, voire inexistants,
ils font la une des journaux et accaparent l'attention, et souvent les crédits
de recherches, tandis que les risques réels (le tabac, l'alcool, les drogues,
les accidents, les suicides des jeunes, l'obésité, la sédentarité, etc..)
qui sont responsables, chez les hommes, de plus de 60 % de décès prématurés
(survenu avant 65 ans), ne sont guère discutés et que les crédits qui leur
sont alloués sont réduits à la portion congrue. Les risques professionnels eux-mêmes sont insuffisamment
étudiés.
Que peut-on faire
contre ces inquiétudes disproportionnées ?
Il faudrait,
d'abord, essayer avec le plus d'objectivité et de rigueurs possibles d'évaluer
quantitativement ces risques. Parler
d'un risque doit être accompagné d'une estimation de sa grandeur. Ceux qui ont la responsabilité de fixer les
normes se trouvent souvent dans des situations difficiles: les groupes de
pressions, les consommateurs peuvent leur reprocher l'insuffisance de la marge
de sécurité. Inversement les acteurs
économiques peuvent récriminer contre le surcroît des coûts et des contraintes. Les autorités doivent donc s'appuyer sur des
experts crédibles et indépendants. D'où
l'importance croissante du rôle des experts scientifiques. Les Académies, notamment celles des sciences
et de médecine, devront en accepter la charge, comme l'a dit le rapport sur
le principe de précaution de Kourilsky-Viney, car elles ont l'avantage d'être
indépendantes des pouvoirs politiques et des intérêts financiers et économiques;
de plus elles sont multidisciplinaires et peuvent, en raison de leur prestige,
faire appel à tous les experts nationaux et internationaux.
De plus, il ne
suffit pas de fixer des normes, il faut insister sur la nécessité de leur
révision périodique, en fonction de l'évolution des connaissances, tantôt
pour les abaisser si les risques avaient été sous-estimés mais aussi les relever
si les données scientifiques ne confirment pas les craintes initiales.
En effet, un
niveau trop bas des normes, outre les inconvénients économiques, pose deux
autres difficultés. D'une part si
le public comprend mal la signification des normes, il s'imagine que quand
la concentration s'approche de la valeur fixée par la
1 Membre de l'Académie
des Sciences et de l'Académie de Médecine. Président du Centre Antoine Béclère.
norme, cela entraîne
déjà un danger et, a fortiori, quand elle le dépasse, il croit que ce danger
devient grave. Or une norme est établie
en supposant une ingestion quotidienne, tous les jours de l'année, de produits
avec la concentration maximale fixée par la norme. Il en résulte que si la norme est dépassée
pendant quelques jours, ou semaines, cela n'aura aucun inconvénient sanitaire
si la concentration est, à d'autres périodes, est très inférieure à la norme.
D'autre part, si le fondement scientifique des normes paraît peu crédible,
cela entraîne un accroissement des infractions par exemple, quand la vitesse
autorisée sur une route paraît trop basse, la limite est moins respectée.
Ainsi une norme
requiert rigueur et objectivité dans l'estimation des risques, transparence
dans le processus de décision (exposé des motifs et analyse précise des risques
visés) et, crédibilité scientifique. Cela impose donc leur remise en question périodique
car il n'est pas de vérité éternelle. Ces exigences sont indispensables à la mise en oeuvre dans de bonnes
conditions d'une réglementation.
La transparence
démocratique s'impose d'autant plus, au niveau d'un pays comme au niveau de
l'Europe, que la fixation d'une norme peut être une façon détournée d'imposer
une politique ou de limiter les échanges internationaux.
Une réunion telle
que celle que nous avons aujourd'hui doit respecter les mêmes critères de
rigueur scientifique et d'objectivité. Elle
doit permettre à des experts dont les points de vue diffèrent, de s'exprimer
et de discuter librement car dans le monde scientifique, il n'est ni tabou,
ni dogme. Cependant, une controverse,
n'est utile que si les arguments s'appuient sur des faits et non sur des opinions.
Les faits ayant été clairement exposés, en reconnaissant et en délimitant
les zones d'incertitude, il appartient ensuite aux hommes politiques de prendre
leur responsabilité en connaissance de cause.
La publication des comptes-rendus de ces controverses peut les y aider.
Over the past
fifteen years, France has been swept by periodic health scares related to
dioxin, peaks in air pollution, radioactive contamination of mushrooms or
wild boar, leukemia around La Hague, pollution from agriculture, nitrates
in drinking water or rivers, and mad cow disease.
Even when scientists
consider these risks to be low, or nonexistent, they appear on the front page
of newspapers. They monopolize research funds as well as the news, while real
risks (tobacco, alcohol, drugs, accidents, suicide rates in the young, obesity,
sedentary lifestyle, etc.), which are responsible for more than 60% of premature
deaths (occurring before the age of 65), are barely discussed and funds allocated
to them are constantly reduced. Furthermore, occupational risks are insufficiently
studied.
What can be done
to counter these disproportionate fears?
First, it is
necessary to try, as objectively and rigorously as possible, to evaluate these
risks quantitatively. Any talk of a risk should be associated with an estimation
of its size. Those responsible for setting standards often find themselves
in a difficult position: pressure groups and consumers may take them to task
for not providing a sufficient safety margin. Conversely, those concerned
by economic considerations may accuse them of increasing costs and constraints.
The authorities must therefore rely on qualified and independent experts,
hence the growing importance of the role of scientific experts. The Academies,
notably the Academy of Sciences and the Academy of Medicine, should take on
this task, as stated in the report by Kourilsky-Viney on the precautionary
principle. These institutions have the advantage of being independent from
political power and financial and economic interests. Moreover, they are multidisciplinary
and, because of their prestige, can call upon national and international experts.
It is not sufficient
to set standards alone, it is also necessary to revise them periodically,
taking into account new developments. Limits should be lowered if risks have
been underestimated, but they should be raised if scientific data do not confirm
original fears.
Too low a limit
presents two other difficulties as well as economic drawbacks. If the public
does not completely understand the significance of a standard, it may believe
that concentrations approaching the fixed standard value signify danger and
when they go over the value, that the danger is serious. But a standard is
established on the basis of a daily intake, all year round, of food containing
the maximum concentration set by the standard. Therefore, if the concentration
is higher than the standard over a few days, or weeks, there will be no negative
health consequences if the concentration is much lower the rest of the time.
Furthermore, if the scientific bases for the standards lack credibility, it
leads to them being ignored. For example, when the speed limit on a road appears
to be too low, it is less respected.
A standard requires
rigor and objectivity in the estimation of the risks, transparency in the
decision-making process (presentation of objectives and precise analysis of
the risks concerned) and scientific credibility. This demands their periodic
review because no truth is eternal. These requirements are indispensable to
the good management of regulations.
Democratic transparency
on the national and European level is especially important so as to avoid
the misuse of regulations as a tool to impose policy or to limit free trade.
A symposium,
such as ours today, must respect the same criteria for scientific rigor and
objectivity. It should provide a forum for experts to express their differing
viewpoints and to discuss freely, because in the scientific community there
should no taboos or dogmas. However, controversy is helpful only when arguments
are based on facts and not opinions. Once the facts have been clearly presented,
and the areas of uncertainty defined, it is the role of politicians to make
the necessary decisions. Publication of these controversies in the proceedings
will help them in their mission.
Module
1
EFFET DES NITRATES SUR LA
SANTE PUBLIQUE ET EPIDEMIOLOGIE
Présidents
de séance :
Professeur Christian CABROL :
Membre de
l'Académie de Médecine – Assistance Publique des
Hôpitaux
de Paris
Docteur Patrick TOUBON :
Groupe physique
Environnement – Université de Rennes
Professeur Claude PAREYN
Professeur Honoraire à l'Université de CAEN
Rappel de l'origine du syndrome
La préoccupation envers les conséquences
néfastes des taux excessifs de nitrates ne date pas d’hier ; la communication
présentée a pour but de situer objectivement quelques jalons de la popularisation
de la hantise qui sont replacés dans le temps.
Ce résumé se borne à évoquer des événements
lointains tels que le travail de J.B. BOUSSINGAULT en 1856, sous Napoléon
III, et le signal d’alarme du vétérinaire MAYO en 1895 confronté à la mortalité
massive de cheptels de ruminants ayant ingéré des surplus de nitrates du CHILI
dans leur fourrage, jusqu’à ce que le Docteur COMLY mette le doigt sur la
cause de mortalité des nourrissons nés dans des fermes isolées.
Les préoccupations et publications de
l’Académie d’Agriculture méritent une attention particulière, car elle se
penche avec pertinence en 1967 et début 1968 sur « un respect méconnu
du problème de l’eau ».
Il y a 144 ans, J.B BOUSSINGAULT s’inquiétait
de la teneur excessive en nitrate de l’eau du puits que la boulangerie de
l’Assistance Publique utilisait pour faire le pain à PARIS.
Professeur Alexander A. AVERY
Hudson
Institute – Center for Global Food issues – Churchville – Virginia - USA
Synthèse des connaissances
actuelles et recommandations sur l'évolution des normes aux USA
L’ingestion des nitrates contenus dans
les eaux de boisson a longtemps été considérée comme une cause majeure de
la méthémoglobinémie des nourrissons. Cependant, des recherches récentes et
un examen historique des cas offre un tableau beaucoup plus complexe des causes
de cette méthémoglobinémie du nourrisson. Des infections gastro-intestinales
et d’autres conditions inflammatoires, et la surproduction de monoxyde d’azote
qu’elles provoquent, apparaissent être la cause essentielle de ces méthémoglobinémies.
Cette conclusion entraîne que les valeurs limites en cours au sujet des nitrates
dans les eaux de boisson qui sont basées uniquement sur les menaces sanitaires
à propos de la méthémoglobinémie du nourrisson semblent inutilement sévères.
Ingestion of nitrates in drinking water has long been thought to be a primary
cause of acquired infantile methemoglobinemia, often called infantile methemoglobinemia.
However, recent research and a review of historical cases offer a more complex
picture of the causes of infantile methemoglobinemia. Gastrointestinal infections
and other inflammatory conditions and the consequent overproduction of nitric
oxide appears to be the primary cause of infantile methemoglobinemia.
This revelation suggests current regulations limiting nitrates in drinking
water, which are based solely on the health threat of infantile methemoglobinemia,
may be unnecessarily strict. Key words:
infantile methemoglobinemia, diarrhea, drinking water, gastrointestinal disturbance,
methemoglobinemia, nitrates, nitric oxide.
Ingestion of nitrates in drinking water has long been thought to be a primary
cause of acquired infantile methemoglobinemia, often called infantile methemoglobinemia.
However, recent research and a review of historical cases offer a more complex
picture of the causes of infantile methemoglobinemia. Gastrointestinal infections
and other inflammatory conditions and the consequent overproduction of nitric
oxide appears to be the primary cause of infantile methemoglobinemia.
This revelation suggests current regulations limiting nitrates in drinking
water, which are based solely on the health threat of infantile methemoglobinemia,
may be unnecessarily strict. Key words:
infantile methemoglobinemia, diarrhea, drinking water, gastrointestinal disturbance,
methemoglobinemia, nitrates, nitric oxide.
Address correspondence to A.A. Avery, Hudson Institute, Center for
Global Food Issues, PO Box 202, Churchville, VA 24401 USA. Telephone: (540)
337-6354. Fax: (540) 337-8593. E-mail: aavery@rica.net
Methemoglobin is a form of hemoglobin in which the heme iron is reduced
to its ferric state and is unable to deliver oxygen. Methemoglobinemia results
when amounts of methemoglobin in the blood become high enough to manifest
clinical symptoms of cyanosis, usually about 15% of total circulating hemoglobin.
Methemoglobinemia occurs for various reasons, including genetic deficiencies
in key methemoglobin-reducing enzymes, genetic abnormalities in hemoglobin
that make the protein more susceptible to oxidation, and exposure to oxidant
drugs and chemicals, including nitrite. Infants under 6 months of age are
particularly susceptible to methemoglobinemia because they have lower amounts
of a key enzyme, NADH-cytochrome b5
reductase (methemoglobin reductase), which converts methemoglobin back to
hemoglobin. Infants begin making adult levels of this enzyme by about 6 months
of age (1). Although it has often
been reported that high levels of fetal hemoglobin in the blood of young infants
contributes to their increased susceptibility to methemoglobinemia, it has
been demonstrated that fetal hemoglobin has the same redox potential and rate
of auto-oxidation as hemoglobin A and therefore does not contribute to the
increased vulnerability (1).
For over 40 years, there has existed a widespread belief that nitrates
in drinking water are a primary cause of infantile methemoglobinemia. Hunter
Comly originally proposed this theory in 1945 in a report in the Journal of the American Medical Association
after treating several infantile methemoglobinemia victims exposed to nitrate-contaminated
water (2). Comly proposed that because
nitrites (NO2-) are known to react directly with hemoglobin
to form methemoglobin, nitrates (NO3-) from drinking
water must be converted to nitrites within the gastrointestinal tract of infants.
Because many infants did not appear susceptible to methemoglobinemia from
nitrate-contaminated water, Comly (2) suggested that the nitrate-to-nitrite conversion might only occur
in the presence of a bacterial infection of the upper gastrointestinal tract,
where such reactions could occur before nitrates are absorbed. These bacterial-derived
nitrites could then react with hemoglobin to form methemoglobin and, in sufficient
quantities, lead to the cyanosis of methemoglobinemia.
Comly's theory (2) became widely
accepted as additional infantile methemoglobinemia cases with elevated nitrates
in the water were reported. Limiting
infant exposure to nitrates was therefore decided to be the most prudent approach
to protecting infant health, and a committee from the American Public Health
Association (APHA) conducted a nationwide survey to determine a safe level
of nitrates in water. Data on a total of 214 cases were compiled. The results
showed methemoglobinemia incidence correlated with increasing nitrate levels
(Table 1) (3). Because no infantile
methemoglobinemia cases were observed with concentrations < 10 ppm nitrate-nitrogen
(nitrate-N), the United States and the World Health Organization established
a maximum contaminant level (MCL) of 10 ppm nitrate-N for nitrate in drinking
water.
Table 1. Reported Cases of Nitrate Water-Induced Infant Methemoglobinemia
Classified According to Nitrate-Nitrogen Concentration of Water Used in Feeding
Formula
|
|
Methemoglobinemia
|
Number of cases associated with indicated
ranges of nitrate-N concentration (ppm)
|
Cases with available data
|
|
State
|
Reported
cases
|
Reported
deaths
|
0-10
|
11-20
|
21-30
|
31-50
|
51-100
|
100+
|
|
California
|
1
|
0
|
0
|
0
|
0
|
0
|
1
|
0
|
1
|
|
Georgia
|
6
|
3
|
—
|
—
|
—
|
—
|
—
|
—
|
0
|
|
Illinois
|
75
|
6
|
0
|
1
|
2
|
2
|
12
|
11
|
28
|
|
Indiana
|
1
|
0
|
0
|
0
|
0
|
0
|
1
|
0
|
1
|
|
Iowa
|
Several
|
11
|
0
|
0
|
0
|
0
|
1
|
1
|
2
|
|
Kansas
|
13
|
3
|
0
|
0
|
1
|
1
|
2
|
8
|
12
|
|
Michigan
|
7
|
0
|
0
|
0
|
0
|
0
|
0
|
7
|
7
|
|
Minnesota
|
139
|
14
|
0
|
2
|
25
|
53
|
49
|
129
|
|
Missouri
|
2
|
0
|
0
|
0
|
0
|
0
|
0
|
2
|
2
|
|
Nebraska
|
22
|
1
|
0
|
1
|
0
|
4
|
9
|
8
|
22
|
|
New York
|
2
|
0
|
0
|
0
|
0
|
0
|
1
|
0
|
1
|
|
North Dakota
|
9
|
1
|
0
|
1
|
1
|
0
|
0
|
6
|
8
|
|
Ohio
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
|
Oklahoma
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
|
South Dakota
|
Several
|
0
|
—
|
—
|
—
|
—
|
—
|
—
|
—
|
|
Texas
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
|
Virginia
|
1
|
0
|
0
|
0
|
0
|
0
|
1
|
0
|
1
|
|
Total
|
278+
|
39
|
0
|
5
|
36
|
81
|
92
|
214
|
|
Percent of Total
|
|
|
0.0
|
2.3
|
16.8
|
37.8
|
43.1
|
100
|
*Based on Table 1 from Walton (3).
Over the last 20 years, however, a more complex picture of infantile methemoglobinemia
causation has emerged which indicates that current limits on drinking water
nitrates may be unnecessarily strict. It is now well established that diarrheal
illness and some gastrointestinal disturbances, typically accompanied by diarrhea
and/or vomiting, can lead to methemoglobinemia in young infants without exposure
to high-nitrate drinking water or exposure to abnormal levels of nitrates
through food. There are literally dozens of reported infantile methemoglobinemia
cases associated with diarrhea without exposure to nitrate-contaminated water
(4-10). Because diarrhea was a prominent
symptom in the majority of drinking water-linked methemoglobinemia cases,
the evidence suggests that diarrhea and/or gastrointestinal infection/inflammation,
not ingested nitrates, are the principle causative factor in infantile methemoglobinemia;
a survey in Germany found that 53% of 306 infantile methemoglobinemia cases
reported diarrhea (11). (Contrary to some reports, diarrhea
and vomiting are not symptoms that typically accompany cyanosis, methemoglobinemia
due to oxidant drug exposure, or genetic abnormalities in hemoglobin.)
A putative mechanism whereby gastrointestinal inflammation leads to methemoglobinemia
has been established. Nitric oxide (NO) is produced by several tissues in
response to infection and inflammation. Increased expression of an inducible
nitric oxide synthase (iNOS) mRNA has been observed in young children with
inflammatory bowel disease during periods of colonic inflammation, but not,
however, in the absence of colonic inflammation (12,13).
A rapid up regulation of iNOS mRNA is also seen in colon epithelial cells
upon infection with enteroinvasive bacteria (14).
Nitrite is a product of nitric oxide metabolism, and increased expression
of iNOS mRNA from colonic inflammation is accompanied by increased stool and
plasma nitrate/nitrite levels (13).
In young infants, overexpression of nitric oxide can lead to nitrite production
sufficient to overwhelm the underdeveloped methemoglobin-reducing system,
resulting in methemoglobinemia. Indeed, methemoglobinemia is a well-known
side effect of nitric oxide therapy for acute respiratory distress syndrome
and persistent pulmonary hypertension in newborns, and such therapy requires
close monitoring of methemoglobin levels (15).
This is supported by observations that infants suffering from diarrhea
and methemoglobinemia (without exposure to nitrate-contaminated water) excrete
up to 10 times more nitrate daily than they ingest through food or water (16). As nitrites are metabolized to nitrates
before excretion, excess nitrate excretion is an indicator of endogenous nitrite
production. Infants with methemoglobinemia associated with gastroenteritis
and/or dehydration also have significantly longer average hospital stays than
infants with methemoglobinemia secondary to oxidant drug exposure, indicating
chronic, endogenous oxidant stress--presumably endogenous nitrite production
from nitric oxide (17). Despite
similar initial methemoglobin levels in the endogenous (mean, 29%) and exogenous
(mean, 28%) groups, children in the endogenous group stayed an average of
19 days in the hospital, whereas in the exogenous group, methemoglobinemia
resolved within 1 day. As Avner et al. (17) stated,
The
shorter, more benign course of illness [of children with methemoglobinemia
due to acute poisoning] may reflect a relatively brief exposure to the oxidant
stress ... compared with ongoing exposure over a prolonged period in children
with methemoglobinemia associated with gastroenteritis and dehydration.
Protein intolerance accompanied by diarrhea and/or vomiting has also been
proven to cause methemoglobinemia in infants less than 6 months of age without
excessive intake of nitrates through food and water (18,19).
Methemoglobin levels over 35% have been recorded in protein-intolerant infants
following brief exposure to the offending protein (18). Moreover, although over 90% of exogenous nitrate exposure comes
from food, the only methemoglobinemia cases linked to food have involved high
levels of nitrite contamination. For example, a typical case involved carrot
juice containing 775 ppm nitrite-N, which is over 700 times the MCL for nitrites
(20). All of these observations
strengthen the view that endogenous nitrite production, not exogenous nitrate
contamination of drinking water, is the primary cause of methemoglobinemia.
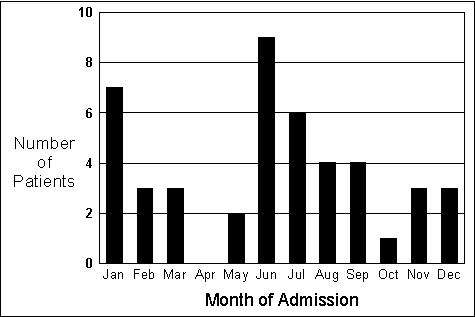
Figure 1. The seasonal variation in the incidence of methemoglobinemia
in a region of Israel during a 12-year period (1980-1992). Data from Hanukoglu
and Danon (19).
Epidemiological evidence suggests that many infantile methemoglobinemia
cases may also have an infectious etiology. A 54-year-old woman who suffered
chronic methemoglobinemia for 15 years saw a disappearance of the condition
after a 10-day course of neomycin (21).
Infantile methemoglobinemia resulting from urinary tract infection has been
reported in over a dozen instances (22,23).
Infectious bacterial and viral gastroenteritis may underlie many infantile
methemoglobinemia cases. Several methemoglobinemia cases have been reported
as resulting specifically from bacterial enteritis or suspected bacterial
sepsis without exposure to high nitrate water (24-26).
Further, an Israeli study of 45 infant methemoglobinemia cases over a 12-year
period (all from urban areas with normal concentrations of nitrate in the
drinking water) revealed a seasonal variation in methemoglobinemia incidence
(19). The incidence of methemoglobinemia
showed two peaks, in January (n
= 7, 16%) and in the summer months (n
= 23, 51%; Figure 1). As Hanukoglu and Danon (19)
noted,
these
[incidence] peaks correspond to times when infectious gastroenteritis is common
(viral agents, especially rotavirus, in winter and bacterial agents in summer).
Hanukoglu and Danon (19) further
noted that the declining incidence of methemoglobinemia observed over a decade
also supported an infectious etiology (Figure 2).
The
incidence of methemoglobinemia was highest before 1980 and decreased significantly
to a minimum during the last 6 years of our survey. This was paralleled by
a significant decrease in infant morbidity and hospitalization rates of patients
with infantile diarrhea due to bacterial pathogens in our hospital during
the same period, despite the increase in the pediatric population in the area
served by our hospital. Presumably the morbidity of non-bacterial gastroenteritis
is also decreasing. A similar trend was also observed over the whole country.
Figure 2. The number of patients hospitalized for methemoglobinemia in a region
of Israel from 1980 to 1992. Data from Hanukoglu and Danon (19).
A similar drop in methemoglobinemia incidence appears to have occurred
in the United States during the 1950s and 1960s.
Implications for Regulation
There are a number of considerations to examine regarding a regulatory
drinking water nitrate limit. We know
that exposure to even high levels of exogenous nitrates in drinking water
is insufficient by itself to cause methemoglobinemia, even among young infants.
This was demonstrated conclusively by experiments conducted with human
infants in the 1940s. Four healthy infants ranging from 2 days to
6 months of age were fed formula prepared with water containing ~100 ppm nitrate-N.
Despite ingesting such highly contaminated formula for more than a
week, the highest methemoglobin level observed was 7.5% with no cyanosis evident
in any of the patients. Even when fed to several infants hospitalized
for methemoglobinemia ostensibly linked to nitrate contaminated water, the
highest methemoglobin level recorded was 11 percent (27). As
the researchers noted, “it appeared that there were other factors in addition
to the quantity of nitrate ion ingested that determined whether or not an
infant became cyanotic.” All available
evidence points to diarrhea, gastrointestinal inflammation (i.e. from protein
intolerance), or infection as the critical factors.
If nitrates do not cause methemoglobinemia, how much do exogenous nitrates
exacerbate methemoglobinemia caused by other factors? This is the critical question for establishing a sound regulatory
health standard for nitrate in drinking water.
The U.S. drinking water standard of 10 ppm nitrate-N was established following
review of data from just 214 cases. As
reported by Walton in 1951 (3),
“Special emphasis was placed on restricting the data to those cases definitely
associated with nitrate-contaminated water.”
This created an inherent bias in both the APHA survey and in the medical
community, where it was assumed that nitrates caused any infantile methemoglobinemia
case with above normal nitrates in the water. By excluding low-nitrate infantile methemoglobinemia
cases, the APHA survey was virtually guaranteed to find that any nitrate concentration
above background was unsafe. If all infantile methemoglobinemia cases had
been included in the APHA survey, not just those with above normal nitrate
levels, it would have been discovered much sooner that severe infantile methemoglobinemia
can occur at all levels of nitrate exposure—from zero ppm nitrate-nitrogen
upward—and that diarrhea and gastrointestinal problems are the real cause.
The medical literature includes reports of cyanosis associated with
diarrhea as far back as 1904.
The current 10 ppm standard is also based on very limited and poor quality
case information. The APHA survey
did not report the presence of nitrite, bacteriologic contamination, gastrointestinal
disease, diarrhea, or methemoglobin concentration. Walton wrote, “It should be noted, that in
many of these cases clinical data were insufficient for definite diagnosis,
and samples of water for the analysis were sometimes collected several months
following the occurrence of the case.” (3) This is hardly a sound scientific basis for
any regulation, let alone one with as much cost to society as the nitrate
standard.
Some groups, especially environmental groups, have used the existence of
methemoglobinemia cases at drinking water nitrate concentrations below 10
ppm nitrate-N to argue that the current federal standard should be reduced
to 5 ppm. At what point does one stop
with this logic? Does the existence
of methemoglobinemia cases at water concentrations of 1 ppm nitrate-N require
a standard below this level?
Conclusion
There is little question that high levels of nitrates in drinking water
can contribute to the severity of methemoglobinemia caused by other factors.
What constitutes “high nitrate levels” is open to debate however, and
this is an area where the unquestioning attitude of the public health community
has stifled research that would have yielded valuable case information and
epidemiological data.
I have argued, based on extensive review of infantile methemoglobinemia
research and a century’s worth of case reports, that the drinking water nitrate
standard could be raised to 15 or 20 ppm without increasing the risks to infants.
This is based primarily on the bias and poor quality data in the single
study on which the current regulatory standard is based, as discussed above.
A more complete data set would likely indicate that methemoglobinemia
cases occurring with water at 15-20 ppm nitrate nitrogen were primarily the
result of bacterial contamination or other severe gastrointestinal causes,
and endogenous oxidative stress, not the relatively low nitrate contribution
from water used to prepare or dilute the infant formula. The vast majority of case reports are with nitrate levels above
30-40 ppm nitrate nitrogen. However,
the problem with any proposed standard is the fact that infantile methemoglobinemia
can occur with zero nitrate exposure, which creates a conundrum: how
does one measure the contribution of relatively low levels of nitrates to
the severity of a infantile methemoglobinemia case in order to establish a
scientifically-sound nitrate standard?
Such a standard is predicated on the false notion that nitrates are
the primary cause of infantile methemoglobinemia.
Much more research on infantile methemoglobinemia is needed before these
questions could be answered with enough clarity to properly advise public
health policy. The answer may also
be that no definite conclusions can ever be drawn and zero exogenous nitrate
exposure is the only absolutely safe exposure for young infants. If that were the case, feeding infants reconstituted
or diluted concentrated formula would be prohibited.
It is clear, however, that limiting nitrates in drinking water is not effective
at preventing infantile methemoglobinemia. The case literature now abounds with cases in which there are no
nitrates in the water. While nitrates
may contribute to the severity of infantile methemoglobinemia, especially
at high levels above 40 ppm nitrate nitrogen, the evidence indicates they
do not cause it. If the goal is protecting
infant health, then the best approach would be to prevent and treat the conditions
that actually cause infantile methemoglobinemia, such as bacterial and viral
gastroenteritis.
Instead of focusing on nitrate levels in drinking water, which has distracted
doctors and public health officials from the real problems, we should educate
everyone that any infant less than six months of age with diarrhea or other
gastrointestinal illness—especially low birth weight and premature babies—is
at risk of infantile methemoglobinemia. The
nitrate scare has fooled us for too long.
References and Notes
1. Lukens JN. The legacy of
well-water methemoglobinemia. JAMA 257:2793-2795 (1987).
2.
Comly HH. Cyanosis in infants caused by nitrates in well water.
J Am Med Assoc 129:112-116 (1945).
3. Walton G. Survey of literature
relating to infant methemoglobinemia due to nitrate-contaminated water. Am
J Public Health 41:986-996 (1951).
4. Yano SS, Danish EH, Hsia
YE. Transient methemoglobinemia with acidosis in infants. J Pediatr 100:415-418 (1982).
5. Bricker T, Jefferson LS, Mintz AA. Methemoglobinemia in infants with enteritis [letter].
J Pediatr 102:161-162 (1983).
6. Danish EH. Methemoglobinemia
in infants with enteritis [letter]. J Pediatr 102:162-163 (1983).
7. May RB. An infant with
sepsis and methemoglobinemia. J Emerg Med 3:261-264 (1985).
8. Kay MA, O'Brien WO, Kessler
B, McVie R, McCabe ERB. Transient organic aciduria and methemoglobinemia with
acute gastroenteritis. Pediatrics 85:589-592 (1990).
9.
Lebby T, Roco JJ, Arcinue EL. Infantile methemoglobinemia
associated with acute diarrheal illness. Am J Emerg Med 11:471-472 (1993).
10. Gebara B, Goetting MM. Life-threatening methemoglobinemia in infants with diarrhea
and acidosis. Clin Pediatr 33:370-373
(1994).
11. Simon C, Manzke H, Kay H, Mrowetz G. Über
Vorkommen, Pathogenese und Möglichkeiten zur Prophylaxe der durch Nitrit verursachten
Methämoglobinämie. Z Kinderheilk 91:124-138 (1964).
12. Gupta SK, Fitzgerald JF, Chong SK, Croffie
JM, Garcia JG. Expression of
inducible nitric oxide synthase (iNOS) mRNA in inflamed esophageal and colonic
mucosa in a pediatric population. Am J Gastroenterol 93:795-798 (1998).
13. Levine JJ, Pettei MJ, Valderrama
E, Gold DM, Kessler BH, Trachtman H. Nitric oxide and inflammatory bowel disease:
evidence for local intestinal production in children with active colonic disease.
J Pediatr Gastroenterol Nutr 26(1):34-38
(1998).
14. Witthoft T, Eckmann L, Kim JM, Kagnoff MF.
Enteroinvasive bacteria directly activate expression
of iNOS and NO production in human colon epithelial cells. Am J Physiol 275:574-571 (1998).
15. Dötsch J, Suha D, Hamm R,
Knothe C, Bauer J, Kühl PG, Rascher W. Extracorporeal circulation increases
nitric oxide-induced methemoglobinemia in
vivo and in vitro. Crit Care
Med 25(7):1153-1158 (1997).
16. Hegesh E, Shiloah J. Blood
nitrates and infantile methemoglobinemia. Clin Chim Acta 125:107-115 (1982).
17. Avner JR, Henretig FM, McAneney
CM. Acquired methemoglobinemia: the relationship of cause to course of illness.
Am J Dis Child 144:1229-1230 (1990).
18. Murray KF, Christie DL.
Dietary protein intolerance in infants with transient methemoglobinemia and
diarrhea. J Pediatr 122:90-92 (1993).
19. Hanukoglu A, Danon PN. Endogenous
methemoglobinemia associated with diarrheal disease in infancy. J Pediatr Gastroenterol Nutr 23:1-7 (1996).
20. Keating JP, Lell ME, Strauss
AW, Zarkowsky H, Smith GE. Infantile methemoglobinemia caused by carrot juice.
N Engl J Med 288:824-826 (1973).
21. Rossi EC, Bryan GT, Shilling
RF. Remission of chronic methemoglobinemia following neomycin therapy. Am J Med 40:440 (1966).
22. Hanukoglu A, Fried D, Bodner
D. Methemoglobinemia in infants with enteritis [letter]. J Pediatr 102:161-162
(1983).
23. Luk G, Riggs D, Luque M.
Severe methemoglobinemia in a 3-week old infant with urinary tract infection.
Crit Care Med 19:1325-1327 (1991).
24. Smith MA, Shah NR, Lobel
JS, Hamilton W. Methemoglobinemia and hemolytic anemia associated with campylobacter jejuni enteritis. Am J Pediatr
Hematol Oncol 10:35-38 (1988).
25. Dagan R, Zaltzstein E, Gorodischer
R. Methemoglobinemia in young infants with diarrhea. Eur J Pediatr 147:87-89
(1988).
26. Jolly BT, Monico EP, McDevitt
B. Methemoglobinemia in an infant: case report and review of the literature.
Pediatr Emerg Care 11:294-297 (1995).
27. U.S. EPA. Another Look:
National Pesticide Survey. Phase II Report. Washington, DC:U.S. Environmental
Protection Agency, 1992.
28. Johnson CJ, Bonrud PA, Dosch
TL, Kilness AW, Senger KA, Busch DC, Meyer MR. Fatal outcome of methemoglobinemia
in an infant. JAMA 257:2796-2797 (1987).
29.
Knobelock L, Krenz K, Anderson H. Methemoglobinemia
in an infant--Wisconsin, 1992. MMWR Morb Mortal Wkly Rep 42:217 (1993).
30.
30.
Roediger WEW, Radcliffe BC. Role of nitrite and nitrate as a redox
couple in the rat colon, implications for diarrheal conditions. Gastroenterology
94:915-922 (1988).
31. Cornblath M, Hartmann AF.
Methemoglobinemia in young infants. J Pediatr 33:421-425 (1948).
32. Faivre J, Faivre M, Klepping
C, Roche L. Methemoglobinemias caused by ingestion of nitrites and nitrates.
Ann Nutr Aliment 30:831-838 (1976).
33. Hack WW, Dowes AC, Verman
AJ. A source of nitrite poisoning in young children. Ned Tijdschr Geneeskd 6:127:1428-1431 (1983).
34. Sander C, Jacobi H. Methemoglobinemia
poisoning in a two year old boy after eating spinach. Z Kinderheilkd 98:222-226
(1967).
35. Ritter R, Schulze U. Methemoglobinemia
following nitrite poisoning by a dinner kohlrabi. Dtch Krankenpflegez 24:223-225
(1971).
36. National Research Council
Subcommittee on Nitrate and Nitrite in Drinking Water. Nitrate and Nitrite
in Drinking Water. Washington, DC:National Academy Press, 1995.
37. Demissie M, Keefer L. Illinois
State Water Survey: Watershed Monitoring for the Lake Decatur Watershed. Champaign,
IL:ISWS Miscellaneous Publication 169 (1996).

Professeur André RICO
Président de la Commission
des Toxiques en agriculture
(Ministère de l'Agriculture)
Membre correspondant
de l'Académie de Médecine
Physiologie
des nitrates chez les mamifères
Les nitrates
sont des composés minéraux de l’azote que l’on trouve naturellement dans les
sols, les eaux, les plantes, les animaux, les insectes.
L’objectif
de ce document est de brosser un rapide panorama de la physiologie des nitrates
chez les mammifères. Cependant, pour mieux comprendre cette physiologie, un
bref rappel des caractéristiques physiques et chimiques des nitrates nous
paraît nécessaire.
RAPPELS DE PHYSIQUE
ET CHIMIE
La structure des nitrates est NO3-.
Ce sont des dérivés oxygénés de l’azote obtenus à partie de l’acide nitrique par
salification.
Au
plan physique, tous les sels métalliques de l’acide nitrique et en particulier
les nitrates de sodium et de potassium sont très hydrosolubles. Cette hydrosolubilité
explique qu’ils ne sont pas cumulatifs chez les mammifères et excrétés aisément.
Au
plan chimique, tous les degrés d’oxydation de l’azote sont possibles entre
–3 et +5. Les nitrates constituent la forme la plus oxydée de l’azote. Les
nitrates sont chimiquement stables.
On
peut obtenir les nitrates à partir de l’oxydation de l’ammoniac et aussi des
dérivés NO, N2O3, NO2-, N2O4.
Inversement,
les nitrates peuvent être transformés par réduction en ammoniac et intermédiaires
moins oxygénés, comme les nitrites.
Ces
différentes réactions, plus spécialement la réduction en nitrite et ammoniac,
sont possibles dans le monde vivant par action de systèmes enzymatiques spécifiques.
ORIGINE (1)
(2)
Chez les mammifères
et l’homme, l’origine des nitrates est double : origine exogène et origine
endogène.
Origine exogène :
Les nitrates sont apportés surtout par l’alimentation et secondairement par
l’eau de boisson. L’essentiel des apports est dû aux végétaux qui sont à l’origine
chez l’homme de 80% des nitrates ingérés, tandis que l’eau de boisson ne représente
habituellement qu’une faible proportion, en général moins de 10 à 15%.
Origine endogène :
Il existe une origine endogène non négligeable des nitrates en particulier
à partir du monoxyde d’azote qui joue comme médiateur chimique de nombreux
rôles chez les mammifères et l’homme.
ABSORPTION (1)
(2) (3) (4)
Une
fois ingérés chez les monogastriques, les nitrates traversent l’œsophage et
arrivent dans l’estomac. Ils sont rapidement et presque totalement absorbés
dans la partie haute de l’intestin grêle. Ils gagnent ainsi le sang où ils
se trouvent mêlée aux nitrates d’origine endogène. Les taux plasmatiques de
nitrates ne sont jamais nuls. Les nitrates sont toujours présents dans le
sang. La nitratémie moyenne se situe entre 3 et 5 mg/l, mais peut aller jusqu’à
10 et 25 mg/l après ingestion conséquente.
Chez
les ruminants, mais pas chez le veau qui est de fait un monogastrique, les
nitrates exogènes sous l’action des microorganismes du rumen sont réduits
en nitrites, qui peuvent se révéler toxiques et aussi en ammoniac.
DISTRIBUTION
ET EXCRÉTION (1) (2)
Les
nitrates sont distribués aux différents organes par le sang et ensuite excrétés
par l’urine et aussi le colon et les fécès. La voie urinaire est prépondérante
chez les mono gastriques lorsque la teneur en nitrates est moyennement élevée.
Chez les polygastriques, elle est beaucoup plus faible. En cas d’ingestion
importante de nitrates, la voie intestinale peut se révéler une voie non négligeable.
Il existe certainement une excrétion active des nitrates au niveau du gros
intestin chez l’homme et chez le cheval. Chez cette dernière espèce la réduction
des nitrates dans le cæcum est très importante à l’image de ce qui se passe
chez les ruminants.
Une sécrétion salivaire non négligeable
existe chez les animaux et chez l’homme à l’exception du rat. Cette sécrétion
salivaire, mais aussi accessoirement sudorale se fait par transport actif.
On peut estimer que 25% des nitrates sanguins chez l’homme se retrouvent dans
la salive. Cette sécrétion varie en fonction de l’ingestion et est maximale
3 à 6 heures après celle-ci.
Au total, l’excrétion reste avant tout
rénale et secondairement intestinale avec une sécrétion salivaire non négligeable.
BIOTRANSFORMATION
DES NITRATES (1) (4) (5)
Nous avons vu dans le premier chapitre
que les nitrates peuvent être réduits en nitrites voire en ammoniac. Cette
réaction se fait par voie enzymatique dans de nombreux microorganismes mais
existe certainement aussi en très faible quantité au niveau de certains tissus.
Ceci est vrai chez l’homme et chez les autres animaux. Chez l’homme, cette
réaction est importante au niveau buccal (nitrites salivaires). On estime
celle-ci à environ 5% des nitrates sécrétés. La réduction en nitrites est
quasi inexistante dans l’estomac sauf en cas de pH anormalement élevé (hypochlorhydrie).
Par contre, elle est importante dans le colon riche en bactéries. Il s’agit
là de la principale source de nitrites endogènes chez l’homme et les monogastriques.
RÔLE DES NITRATES
(1)
Les nitrates, bien qu’étant des électrolytes, n’interviennent pas dans la
régulation de la pression osmotique sanguine et cellulaire. On pourrait leur
reconnaître un rôle dans le cadre de la sécrétion salivaire : ils présenteraient
des activités antibactériennes voire biochimiques sur le préparation des aliments
à la digestion
En ce qui concerne l’excrétion colique,
elle est aussi nécessaire à l’équilibre et à l’activité normale de la flore
intestinale.
TOXICITÉ DES
NITRATES (5) (6)
Bien que ne faisant pas partie de la physiologie, la toxicité ne doit pas
être oubliée. Disons simplement que par eux-mêmes les nitrates ne sont pas
toxiques. Leur toxicité est essentiellement rattachée à leur biotransformation
en nitrites, qui peut être à l’origine chez les jeunes enfants et les ruminants
d’accidents de méthémoglobinisation.
En conclusion et résumé, la physiologie des nitrates chez
les mammifères est simple. Les nitrates sont apportés par l’alimentation,
surtout par l’ingestion de végétaux, mais aussi synthétisés dans l’organisme.
Compte tenu de leur solubilité, ils sont éliminés aisément par voie urinaire
et secondairement intestinale et ils ne s’accumulent pas. Ils sont sécrétés
dans la salive et aussi par le colon. Leur transformation bactérienne en nitrites
peut être source de méthémoglobinisation rapportée, dans certaines conditions,
chez les jeunes enfants et les autres espèces animales comme les ruminants.
BIBLIOGRAPHIE
1
Technical report N°27 : Nitrates and drinking water. ECETOC. Brussels (1988) 1-164.
2
L’Hirondel J. et l’Hirondel
J.L. : Les nitrates et l’homme, le mythe de leur toxicité. Monographie (1996).
3
Schneider N.R. and Yeary R.A. : Nitrites and nitrates, pharmacokinetics
in the dog, sheep and poney. Am. Jal. Vet. Res. 36 (1975) 941-947.
4
Bruning-Fann C.S. and Kaneene J.B. : The effects of Nitrates, Nitrites
and N-Nitroso compounds on animal health. Vet. Human Toxicol. – 35 (3) (1993)
237-253.
5
Vittozzi L. : Toxicology of nitrates and nitrites. Food Add. and Contam.
9, n° 5 (1992) 579-585.
6
Bruning-Fann C.S. and Kaneene J.B. : The effects of Nitrates, Nitrites
and N-Nitroso compounds on human health.. A review. Vet. Human toxicol. –
35 (6) (1993) – 521.531.
Professeur Etienne FOURNIER
Académie des Médecine
Professeur Honoraire
de Clinique Toxicologique
Hôpital Ferdinand
Vidal – PARIS
Existe-t-il
une science toxicologique ?
La toxicologie est une discipline qui
observe les effets pour l’homme des produits chimiques, simples ou composés,
naturels ou résultant de l’activité humaine. Elle suppose des connaissances
médicales et des connaissances chimiques.
Les intoxications aiguës sont parfaitement
connues depuis plus d’un siècle et la description des effets nocifs survenant
en quelques jours ou quelques semaines s’accumulent dans tous les livres de
toxicologie.
Pour les affections d’apparition lente,
lors de l’utilisation d’eaux chargées en minéraux comme les fluorures ou certains
dérivés de l’arsenic, les intoxications chroniques (fluoroses, arsenicismes)
sont bien connues.
Depuis des décennies, une réglementation
mondiale définit ce que la collectivité scientifique appelle l’eau potable.
Les ions nitrates y figurent au taux maximum de 50 mg/l. Il ne s’agit pas
de concentrations dangereuses ou nuisibles à la santé d’une collectivité,
mais d’un taux dit de précaution.
Est-il utile de réclamer une eau potable
contenant moins de minéraux dissous ? La réponse médicale est évidemment
non.
L’augmentation du facteur de sécurité
peut être une satisfaction intellectuelle ou idéologique, mais aucun toxicologue
ne s’attache à la surabondance des précautions inutiles.
Le cas des nitrates est exemplaire, parce
que le taux nocif dans l’eau de boisson n’est pas réellement « connaissable »
puisque ces ions sont présents dans les aliments végétaux et que l’analyste
ne peut différencier dans un estomac humain la part revenant à l’eau et celle
revenant aux aliments : donc la question n’a aucun sens.
En résumé, première notion toxicologique
fondamentale : tout ion nitrate absorbé qu’il provienne de l’eau, des
aliments (ou de l’air respiré) est identique à son voisin. C’est une loi de
chimie des molécules, connue depuis plus de deux siècles.
Rappel de toxicologie « quasi-expérimentale »
aiguë des nitrates .
Depuis des siècles, les nitrates sous
forme de sel de potassium (sel de terre, salpêtre) ont été prescrits à la
dose de plusieurs grammes par des médecins. Ils étaient considérés essentiellement
comme diurétiques en cas d’œdèmes cardiaques, diurèse vraisemblablement obtenue
par la concentration osmotique de l’urine riche en nitrate ; c’est encore
le composant essentiel de nombreuses tisanes.
Les nitrates ne sont pas irritants, allergisants,
mutagènes, ou tératogènes aux doses absorbées par la population. Donc pas
de menace de maladies tardives, pas de crainte pour la Santé Individuelle.
Les seules anomalies authentiquement écrites
par les médecins pédiatres et les toxicologues (humains et vétérinaires) sont
des cas de cyanose avec méthémoglobinémie rares, observés chez les nourrissons
absorbant des biberons trop riches en nitrites.
Deuxième constat évident, mais essentiel
Les nitrates ajoutés à l’hémoglobine ne
forment pas de méthémoglobine.
Or, une règle de la toxicologie impose
pour toute intoxication une explication chimique, un mécanisme comprenant
une formule de réaction, un équilibre par loi d’action de masse, des inhibiteurs
et des catalyseurs. Les nitrites se présentent comme de bons candidats à l’intoxication.
Ils sont rapidement absorbés, forment des dérivés nitrosés biologiques. De
vieilles pratiques de charcuterie utilisent des nitrites pour donner aux viandes
conservées une belle couleur rouge de nitroso-myoglobine. A dose suffisante,
les ions nitrite débordent l’action d’une méthémoglobine réductase physiologique
présente dans l’hématie.
Le toxicologue qui n’observe pas de cyanose
tant avec les nitrates qu’avec une petite quantité de nitrites dira au minimum
et très naturellement toxicité des nitrates = Impossible.
Confronté aux
observations des pédiatres, très peu nombreuses mais indiscutables, il s’interroge
et cherche un mécanisme réducteur puissant, éventuellement une disposition
génétique, congénitale ou pathologique expliquant la sensibilité du nourrisson.
Les théories explicatives modernes de
la nocivité des produits nitratés chez le nourrisson passent en effet par
une étape réductrice bactérienne avec formation de nitrites, directement méthémoglobinisants
chez certains nourrissons dont la fonction méthomoglobine-réductase physiologique
est peu active. La formation de nitrites serait la conséquence des pullulations
de bactéries réductrices existant soit dans le biberon, soit dans le colon
de l’enfant, important réservoir bactérien (normal ou pathologique – les diarrhées
sont fréquentes).
L’hypothèse biberon est de loin la plus
solide car son contenu est un milieu de cultures idéal.
Interdire de donner aux nourrissons une
eau contenant plus de 50 mg/l de nitrates n’est qu’une précaution accessoire.
L’important étant que l’eau ne contienne pas de germes pathogènes, banal problème
d’hygiène…
Le taux en nitrates étant nettement plus
élevé dans la plupart des bouillons de légumes, soupes et purées végétales,
leur conservation doit aussi être surveillée et les mères instruites du danger
potentiel. Depuis les découvertes Pastoriennes, l’hygiène de l’eau passe par
sa non contamination par des déchets et des rejets organiques en raison de
la transmission toujours possible de germes du genre Colibacilles, Salmonelles
et autres facteurs de diarrhées, infections et toxi-infections graves.
La présence de nitrates dans les végétaux
comestibles étant constante, le toxicologue clinicien qui ne constate aucune
perturbation de la santé des végétariens et des végétaliens est parfaitement
tranquille, aussi bien pour l’individu que pour les générations successives,
dès lors que les carences sont évitées.
Une troisième loi de la toxicologie moderne
rappelle que les nuisances ne sont pas synonymes d’intoxications immédiates
ou tardives. La première nuisance chimique est l’odeur.
Des liquides biologiques aussi abondants
que la salive contiennent des nitrites physiologiques.
Le suc et contenu gastrique au contraire
n’en contiennent pratiquement pas malgré l’absorption de salive, ce qui suppose
un passage extrêmement rapide des nitrites vers le sang, puis une destruction
rapide dans l’estomac.
C’est un point
essentiel de toute discussion toxicologique. Les produits « anthropiques »,
synthétisés par l’homme aux concentrations physiologiques, sont difficilement
retenus comme cause normale de cancers, de maladies dégénératives, d’apoptoses
et de vieillissement prématurés.
Quid des nitrosamines ?
Expérimentalement l’ingestion prolongée
à doses élevées, prolongées et compatibles avec la survie, d’un mélange de
nitrite de sodium et de certaines amines provoque indiscutablement des cancers
gastriques chez le rat, mais l’estomac de l’homme normal ne contient pratiquement
pas de nitrites.
Les nitrosamines (alimentaires ?)
devraient avoir une action limitée à la cavité buccale. Encore faudrait-il
les trouver là. A ce niveau, on parle plutôt de l’effet du tabagisme et de
l’alcool.
Sauf à parler de cancérogenèse endogène,
il est difficile de faire jouer un rôle mutagène et/ou cancérogène à une série
radicalaire fabriquée dans l’organisme humain (anthropique) et qui conduit
aux nitrites et nitrates.
Vient la très importante découverte des
oxydes d’azote biomédiateurs vasculaires et produit de défense cellulaire,
nouveauté d’importance considérable, NO et NO2 étant effectivement synthétisés
dans l’organisme humain à partir d’aminoacides proches du cycle de l’urée.
Le cycle des oxydes d’azote va répondre
très simplement aux observations d’allure paradoxale comme la synthèse « in
situ » de NO, puis de nitrites, comme l’effet thérapeutique d’esters
nitrés organiques comme le trinitrate de glycérol, trinitrine ou nitroglycérine.
NO a été reconnu comme un régulateur physiologique
de la circulation sanguine (ce qui n’est pas indiqué dans la plupart des rapports
officiels, alors que le phénomène était connu de tout biologiste).
Le radical NO est normalement formé dans
l’organisme par un groupe d’enzymes : les Monoxydes d’azote-Synthases,
enzymes oxydants puissants puisqu’ils réalisent précisément la formation de
NO à partir d’aminoacides.
En conclusion, le thème nitrates est paradoxalement
utilisé comme symbole de toxicité, alors qu’il s’agit de produits dont la
toxicité humaine pratique (risk) aiguë, subaiguë et chronique est strictement
nulle. Loin de s’indigner de tels contresens, le toxicologue constate simplement
les énormes dérives de l’information de vulgarisation par rapport aux connaissances
scientifiques les plus simples.
Professeur Christophe DUPONT
Hôpital St Vincent
de Paul - Service néanatologie
Assistance Publique
des Hôpitaux de Paris
Méthémoglobinémie
et morbidité des nitrates : maladie du nourrisson – conséquences cliniques
A - Nitrates et nitrites
1. Pourquoi les nitrates sont ils dangereux pour le petit enfant
L’excès de nitrates est dangereux chez
l’enfant de moins de 3 mois et peut même l’être jusqu’à 5 mois : les bactéries
intestinales réduisent les nitrates en nitrites qui peuvent franchir la barrière
intestinale à cet âge, parvenir dans la circulation où ils transforment l’hémoglobine
en méthémoglobine. Dans l’hémoglobine, le fer, qui est l’élément essentiel
de la fonction de transport de l’oxygène et du gaz carbonique, est bivalent
: Fe++ (fer ferreux). Les poisons méthémoglobinisants (nitrites, aniline,
etc) le transforment en fer ferrique trivalent Fe+++, ce qui fait perdre toutes
ses propriétés physiologiques à l’hémoglobine entraînant une méthémoglobinémie,
potentiellement mortelle, en l’absence d’administration d’une substance réductrice
par voie veineuse: bleu de méthylène ou acide ascorbique dans sa forme réduite.
2. Le risque d'intoxication de l'enfant
Le risque d'intoxication de l'enfant par
les nitrates ne fait plus en France l'objet d'un intérêt considérable, probablement
en raison de la bonne maîtrise de ce type d'intoxication à laquelle est parvenu
notre pays.
Les dernières observations de méthémoglobinémie
publiées en France remontent à 1983, date à laquelle ont été décrites (Blanc
et al, Pédiatrie, 1983, 38: 87-99) 8 cas chez des enfants ayant présenté une
diarrhée aiguë. Quatre d'entre eux avaient reçu pendant longtemps un apport
exagéré en soupe de carotte riche en nitrite et nitrates. Quatre autres avaient
présenté une diarrhée sévère, au cours de laquelle un mécanisme de nitrification
endogène par prolifération microbienne était envisagé. Dans tous les cas le
taux de méthémoglobinémie était faible, plus un symptôme qu'un facteur de
risque, contrairement à ce qui est actuellement décrit dans de nombreux pays
en voie de développement, comme par exemple 80 cas d'intoxication aiguë en
Chine (Gao et Guo, Am J Emerg Med, 1991, 9: 200-201).
Le potentiel toxique des nitrates envers
les fonctions de reproduction a également été envisagé. Une revue récente
a montré que chez l'animal, le risque tératogène des nitrates n'était pas
démontré et qu'un effet adverse sur la reproduction n'était observé qu'à une
dose 1000 fois supérieure aux ingesta humain habituels (Fan et al, Regul Toxicol
Pharmacol, 1987, 7: 135-148).
Pour autant le risque d'intoxication par
les nitrates est-il si limité?
Ce risque est lié à la consommation de
l'eau. L'eau est essentielle à la vie. Pour les enfants, ce besoin est encore
plus considérable, estimé à 3 fois les besoins de l'adulte, compte tenu du
poids corporel. C'est cette consommation élevée qui rend l'enfant plus sensibles
aux intoxications insidieuses. Or la contamination de l'eau du sol et de l'eau
potable en zone rurale à partir du bétail et des excréments humains reste
un risque largement répandu dans le monde. Il n'est pas exclu que ce risque
étant actuellement sous estimé, la méthémoglobinémie puisse ne pas être reconnue
et ainsi responsable de certaines affections de l'enfant et notamment de certaines
morts subites, comme cela a été rapporté au cours des années 8O dans certains
états d'Amérique du Nord (Johnson et Cross, Am J Int Med, 1990, 18: 449-456).
La maîtrise de la qualité de l'eau potable
demeure donc un enjeu considérable a travers le monde. Un équilibre correct,
de bonnes qualités gustative, physique, chimique, bactériologique sont nécessaires
pour la rendre potable. Une concentration
maximum de 45 ppm d'ion nitrate ou de 10 ppm de nitrate azote semble de bonne
efficacité protectrice pour le très jeune enfant (Fan et al, Regul Toxicol Pharmacol, 1987,
7: 135-148).
En France, deux lois concernant l'eau
potable ont été promulguées récemment (janvier et juin 1989), l'une traitant
de la consommation humaine et l'autre traitant de l'eau minérale. L'eau du
robinet et l'eau minérale sont sous stricte surveillance. Pour les enfants
de moins de 4 mois, il est recommandé d'utiliser de l'eau minérale, avec un
compte minéral réduit, notamment un taux de nitrates inférieur à 15 mg/l.
Les bouteilles en plastique sont aussi sures que les bouteilles en verre.
Docteur Brigitte PIGNATELLI
Service des facteurs
endogènes de risques de cancer
International Agency for Research on Cancer (CIRC – OMS)
LYON
Risque
de cancérogénicité des nitrates
à
long terme ?
Eléments
d'évaluation
La question de savoir si l’exposition
au nitrate peut constituer un facteur de risque de cancer pour l’homme est
loin d'être résolue. La réduction du nitrate par une large variété de microorganismes
peut produire des agents nitrosants susceptibles de générer des composés N-nitrosés
(CNO) cancérogènes in vitro et in vivo.
Environ 90 % des 300 CNO étudiés induisent
des tumeurs dans une grande variété d’organes chez 41 espèces animales incluant
des primates et n'épargnent probablement pas l'homme. Les CNO figurent parmi les plus puissants cancérogènes
connus et de faibles doses, parfois une seule, de ces CNO suffisent à induire
des tumeurs chez l’animal. Les CNO
exercent leurs effets cancérogènes après leur conversion métabolique (nitrosamines)
ou non enzymatique (nitrosamides) en dérivés instables et réactifs qui constitutent
les cancérogènes ultimes. Les espèces actives alcoylantes formées sont de
puissants électrophiles qui peuvent réagir avec les sites nucléophiles des
macromolécules cellulaires telles que ADN, ARN et protéines. L’ADN constitue
la cible cellulaire critique car certaines lésions non réparées avant la réplication
peuvent conduire à des mutations. Celles-ci peuvent initier une transformation
néoplastique. Les voies métaboliques des CNO, la formation d’adduits et les
mécanismes de réparation de l’ADN ainsi que les symptômes de toxicité aiguë
apparaissent similaires chez l’animal et chez l’homme. Le cancer humain (leucémie
aiguë non lymphocytaire) a été induit par des médicaments cytostatiques de
la famille des nitrosourées utilisés en chimiothérapie. L’utilisation de tabac
à chiquer serait responsable de l’accroissement de l’incidence du cancer de
la cavité buccale avec une haute probabilité.
La réduction du nitrate en nitrite ou
NO produit des agents nitrosants pouvant conduire aux CNO cancérogènes suite
à leur réaction avec des substrats azotés.
Ces agents (NO+, N2O3, N2O4,
NOX) peuvent réaliser la nitrosation dans des conditions et milieux variés.
Certaines bactéries, notamment présentes dans le suc gastrique humain, agissent
comme catalyseurs efficaces de la réaction de N-nitrosation, et générent des CNO. Certains anions catalysent la
formation des CNO, alors que d’autres composés, tels que les vitamines C et
E, des composés phénoliques et mélanges naturels les contenant peuvent l’inhiber.
En particulier, légumes et fruits sont très riches en composés inhibiteurs
de la N-nitrosation. Alors que les
nitrosamines volatiles et les nitrosaminoacides ont été beaucoup étudiés,
la nature des CNO formés in vivo
ou préformés dans l'environnement reste encore largement mal connue.
La réduction du nitrate est réalisée par
une large variété de microorganismes. Certaines circonstances, par exemple
de mauvaises conditions de stockage, accroissent la vitesse de transformation
bactérienne du nitrate. Ainsi des
produits naturellement riches en nitrate accumulent du nitrite, la formation
de CNO pouvant survenir subséquemment. L’étude de l’absorption et du métabolisme
du nitrate montre qu’il peut être une source de nitrite dans différents compartiments
in vivo. Le nitrate ingéré est absorbé
au niveau du tractus gastrointestinal dans la circulation sanguine. Il se
trouve ensuite transporté pour environ 25 % jusqu’aux glandes salivaires.
La réduction bactérienne dans la cavité buccale est affectée par le pH salivaire
et la composition de la microflore, elle-même dépendante de la nutrition et
de l’état de santé des personnes. Dans l’estomac, l’achlorhydrie permettant
une colonisation bactérienne peut entraîner la présence de teneurs élevées
de nitrite. Le nitrate peut aussi subir une réduction dans l’intestin grêle
et la vessie. La biosynthèse endogène de NO et donc de nitrate est réalisée
à partir de l’arginine par certaines cellules en réponse à une stimulation
immunologique lors d'états inflammatoires ou infectieux. La synthèse endogène
de CNO chez l’animal et chez l’homme a été largement démontrée, en particulier,
grâce à la mesure de nitrosoproline et autres nitrosaminoacides dans l’urine.
Des études ont permis de démontrer que : a) l’exposition au nitrate
peut être corrélée à la capacité de nitrosation endogène ; b) la nitrosation
endogène est modulée par des composés inhibiteurs tels que les vitamines C,
E, les composés phénoliques et des mélanges naturels complexes ; c) la capacité
de nitrosation endogène est corrélée à un taux élevé de cancers (estomac,
oesophage) dans certaines populations ; d) La nitrosation endogène est plus
élevée dans des états pathologiques associés à un risque accru de certains
cancers.
Un gand nombre d’études épidémiologiques
visant à mettre en évidence une corrélation entre le taux de mortalité ou
l’incidence de certains cancers (estomac, oesophage) et l’exposition au nitrate
ont été réalisées dans de nombreux pays. Des résultats contradictoires ont
été obtenus. Ces divergences peuvent être expliquées par des difficultés liées
à la mesure de l’exposition au nitrate, telles que : a) la diversité des indicateurs
et des méthodologies utilisés ; b) certaines habitudes alimentaires ; c) l’apport
conjoint nitrate/vitamines, produits phénoliques et autres composés
inhibiteurs de la nitrosation et modulateurs de la cancérogenèse ; d) les pollutions accompagnant celle du nitrate
(pesticides, arsenic) ; e) la période de latence entre l’exposition au nitrate
et la maladie ; f) les mouvements des populations. De plus, la nature de la
source d’exposition au nitrate pourrait être d’importance capitale. En effet,
alors que les légumes apportent conjointement au nitrate des éléments protecteurs,
inhibiteurs de la nitrosation (e.g. vitamine C, polyphénols) l’eau, source
possible de nitrate, est dépourvue de tels éléments. La corrélation entre
l’exposition au nitrate et le risque de cancer de l’estomac peut varier en
fonction du type de légumes, sources de nitrate (e.g. légumes verts par rapport
aux céréales).
Le nitrate apparaît comme un élément parmi
les multiples facteurs impliqués dans la formation endogène de CNO, en particulier
: a) La capacité de réduction du nitrate
en nitrite in vivo et l'étendue
de la nitrosation bactérienne, dépendantes de l'existence, de la nature et
de l'activité des bactéries dans la cavité buccale, dans un environnement
gastrique achlorhydrique ou dans d'autres sites infectés comme la vessie;
b) le flux salivaire ; c) la nature et la concentration des substrats nitrosables
; d) la présence de catalyseurs ou d’inhibiteurs de la nitrosation ; e) le
pH du compartiment corporel concerné.
Les données actuelles des études épidémiologiques ne permettent pas
de tirer une conclusion définitive quant au risque cancérogène dû à l’exposition
à de fortes concentrations de nitrate. Des études du risque individuel de
cancer en fonction de l’exposition individuelle au nitrate plutôt que des
comparaisons globales seraient probablement plus informatives. L'exposition
au nitrate pourrait constituer un élément nécessaire mais insuffisant du risque
cancérogène qui dépendrait largement de facteurs individuels. Face à la complexité
de la situation, aux informations disponibles largement incomplètes, à l'existence
de certains groupes de population pouvant présenter une sensibilité particulière
(achlorhydrie gastrique, infections microbiennes), ainsi qu'à la présence
ubiquitaire de bactéries dans notre environnement, le risque ne peut pas être
écarté. Il semble justifié de rechercher des moyens de prévention pour éviter
l’exposition de l’homme au CNO notamment en limitant les concentrations de
leurs précurseurs dans l’environnement et en particulier celles de nitrate.
Il serait souhaitable d'éviter de trop fortes teneurs en nitrate dans les
légumes pour conserver leurs effets bénéfiques en évitant un risque à long
terme pour la santé humaine. Quant
aux normes actuelles admissibles de nitrate dans l'eau, la prudence recommande
leur maintien.
Docteur Jean-Louis L'HIRONDEL
CHRU CAEN
Dualité
des nitrates
Nitrates
et méthémoglobinémie : essai de clarification sur la santé
NITRATES
ET METHEMOGLOBINEMIE DU NOURRISSON
ESSAI
DE CLARIFICATION
Comme le précise
en 1995 le Comité Scientifique de l’alimentation humaine de la Commission
Européenne, l’ensemble des travaux épidémiologiques entrepris au cours des
dernières décennies ont échoué dans leur tentative de démontrer une quelconque
carcinogénicité des nitrates (EU, 1995). La réglementation des taux de nitrates
dans l’eau de boisson n’a ainsi actuellement d’autre intention que de chercher
à prévenir la méthémoglobinémie du nourrisson (WHO, 1993).
De ce fait, le thème nitrates-méthémoglobinémie du nourrisson est crucial ;
il mérite d’être examiné de près.
Tentant d’apporter des éléments de
clarification à un débat qui dure depuis plus de cinquante ans, l’auteur met
l’accent sur quatre idées ou notions qui, quoique erronées, continuent à avoir
cours.
Ces quatre idées erronées sont celles
qui consistent à considérer :
-
que
les nitrates de l’alimentation peuvent être transformés en nitrites in vivo dans le tube digestif du nourrisson,
-
que,
dans un biberon contenant des nitrates, les nitrites commencent à apparaître
dès le début de la prolifération bactérienne,
-
que
les données épidémiologiques relatives à l’eau de puits et au risque méthémoglobinémique
qu’elle fait courir sont transposables à l’eau du robinet,
-
enfin
que les normes établies pour les taux de nitrates dans l’eau potable, donc
entre autres dans l’eau du robinet, ont jadis été fondées sur des bases scientifiques
solides.
Au contraire, comme le montrent les faits
et données scientifiques rapportés par l’auteur,
-
quand
elle se produit et est à l’origine d’une méthémoglobinémie du nourrisson,
ce qui est devenu de nos jours tout à fait exceptionnel, du moins aux Etats-Unis
et en Europe Occidentale, la transformation nitrates-nitrites se fait dans
le biberon, à l’occasion d’une faute d'hygiène caractérisée ;
-
la
transformation nitrates-nitrites dans le biberon ne commence à apparaître
que lorsque la prolifération bactérienne est déjà très avancée ; le seuil
de prolifération bactérienne au delà duquel la transformation nitrates-nitrites
commence à apparaître se situe autour de
107 germes ml-1 ;
-
quels
qu’aient pu être par ailleurs ses concentrations en nitrates (en Europe, elles
dépassent encore souvent la norme de 50 mg NO3- l-1),
jamais l’eau du robinet, bactériologiquement saine et contrôlée, n’a été à
l’origine du moindre cas, certain et vérifié, de méthémoglobinémie du nourrisson,
-
enfin,
la réglementation actuelle des taux de nitrates dans l’eau du robinet est
consécutive à une interprétation défectueuse de l’enquête menée en 1949-1950
par l’American Public Health Association (1949-1950) ; le raisonnement
qui la sous-tend est fondé sur un biais méthodologique.
Ainsi, quels
que soient ses taux de nitrates, l’eau du robinet, qui est bactériologiquement
saine avec moins de 10² germes ml-1, ou à l’extrême rigueur moins
de 103 germes ml-1, ne fait courir aucun risque méthémoglobinémique
au nourrisson. Par ailleurs, qu’ils viennent des légumes ou de l’eau de boisson,
les nitrates alimentaires ne se montrent nullement cancérigènes. Actuellement
l’accent est mis au contraire sur leurs effets bénéfiques. Les nitrates alimentaires
exercent un important rôle protecteur à l’égard des infections digestives ;
il est également possible qu’ils exercent un rôle protecteur à l’égard des
maladies cardiovasculaires.
Les nitrates alimentaires ne sont pas
nocifs. Ils sont au contraire bénéfiques. Lorsqu’elles en prendront conscience,
les autorités sanitaires inverseront leur position en recommandant les alimentations
et régimes richement nitratés.
Nitrate and infant Methaemoglobinaemia
- attempting to clarify the debate
-
Jean Louis L'Hirondel
As the World Health Organisation states (WHO, 1993), “the Guideline value
for nitrate in drinking-water is established solely to prevent methaemoglobinaemia”.
The topic on nitrate and infant methaemoglobinaemia is of importance. The
author attempts to clarify the issue in a debate that has lasted for fifty
years; he lays stress on four statements that, though erroneous, are still
currently expressed.
These four erroneous statements are as follows:
-
Dietary nitrate can be reduced into
nitrite in vivo in the infant digestive
tract.
-
In a feeding bottle containing nitrate,
reduction to nitrite starts and occurs as soon as the bacterial proliferation
begins.
-
Epidemiological data on well water
and risk of methaemoglobinaemia can be applied to tap water.
-
Regulations for nitrate content in
drinking water, especially in tap water, have been grounded formerly on solid
bases.
On the contrary, as shown in this paper,
-
The reduction of nitrate to nitrite
that causes infant methaemoglobinaemia takes place in the feeding bottle as
a result of a clearly unhygienic condition.
-
For reduction nitrate-nitrite to start
and occur in a feeding bottle, it is necessary for the bacteria to proliferate
up to a threshold: 107 germs ml-1.
-
Whatever its nitrate concentrations,
tap water, that is bacteriologically controlled, has never been responsible
for a real and unquestionable case of infant methaemoglobinaemia.
-
Finally, the official limits for nitrate
content in tap water are based on the results of an American Survey (APHA,
1949-1950), that were subsequently misinterpreted; a methodological bias escaped
then the attention of analysts.
Professeur
Nigel BENJAMIN
Head of Department – Clinical Pharmacology
St Bartholomew's and the Royal London School of Medecine
LONDON
Nouveaux
effets bénéfiques des nitrates
La synthèse de
l’oxyde nitrique consécutive à l’oxydation de l’arginine est maintenant bien
connue. Nous avons recherché la possibilité que l’oxyde nitrique puisse être
obtenu par des enchaînements de réduction, à partir de nitrate minéral, chez
l’homme bien portant.
Les nitrates
ingérés chez l’homme, proviennent principalement des légumes verts et de l’eau
de boisson. A la suite de leur absorption dans l’estomac et la partie supérieure
de l’intestin grêle, ceux-ci sont concentrés dans la salive, environ dix fois.
Les nitrates salivaires sont rapidement réduits en nitrites, en présence de bactéries qui siègent à la surface
de la partie inférieure de la langue. Ces bactéries sont anaérobies facultatives,
et utilisent le nitrate comme accepteur d’électron en l’absence d’oxygène.
Ceci entraîne des concentrations en nitrite élevées dans la salive, qui, après
déglutition, est acidifié dans l’estomac. L’acidification des nitrites donne
de l’acide nitreux qui se décompose spontanément pour former de très hautes
concentrations d’oxyde nitrique. Nous avons nommé ce mécanisme « circulation entéro-salivaire des nitrates »
(enterosalivary circulation of nitrate).
Suite à l’ingestion
de 2mMoles de nitrate (dose contenue dans 50g de laitue), la concentration
d’oxyde nitrique s’élève d’une valeur de base de 15 ppm à un pic de l’ordre
de 100 ppm. Si ces nitrates sont donnés de même que de la laitue, l’augmentation
d’oxyde nitrique beaucoup plus forte dans les gaz stomacaux, et peut atteindre
plus de 400ppm chez certains sujets. Ces concentrations d’oxyde nitrique sont
toxiques pour un grand nombre de microorganismes.
Nous
disposons de preuves que l’objet de cette synthèse d’oxyde nitrique intragastrique
porte sur la protection contre les agents pathogènes ingérés, mais également,
pourrait jouer un rôle en maintenant un flux de sang dans la muqueuse gastrique.
Un grand nombre d’agents pathogènes intestinaux, tels que Escherichia Coli
et Salmonella sont éliminés par l’oxyde
nitrique obtenu à partir des nitrites et de l’acide. Des premiers résultats
chez des sujets exposés à des environnements contaminés semblent indiquer
qu’une haute dose de nitrate ingérée peut protéger contre des infections dues
à des aliments ou de l’eau souillés.
Nous avons également
montré que la production d’acide nitrique sur la peau, était consécutive à
la réduction des nitrates et nitrites, plutôt qu’à l’oxydation de l’arginine ;
ceci peut, à nouveau, s’avérer fondamental dans la protection contre les infections.
Nous avons montré que les nitrites de la salive, après application sur la
peau, provoquent la production de grandes quantités d’oxyde nitrique, et nous
en avons déduit l’hypothèse que l’oxyde nitrique produit pendant le léchage
des plaies pouvait avoir un effet antimicrobien, grâce à ce mécanisme.
Plus récemment, nous
avons étudié l’effet de l’application d’acides organiques et de nitrites sur
des peaux humaines malades et nous avons mis en évidence que cette association
était efficace pour soigner diverses maladies infectieuses de la peau.
De
ces travaux, nous avons obtenu de nouvelles perspectives au sujet du nitrite
minéral et de la santé humaine. Plutôt que d’être un « polluant »,
ou une substance toxique, il semble maintenant que les nitrates du régime
constituent un composant essentiel d’un régime sain qui nous protège contre
un grand nombre de maladies infectieuses. Des travaux récents ont confirmé
que des individus qui consomment plus de nitrates sont également moins sujet
à développer des cancers. Le danger pour les jeunes enfants de concentrations
élevées de nitrates dans l’eau ont probablement été surestimés.
En
conclusion, les réglementations qui limitent l’apport de nitrate des aliments
et de l’eau de boisson doivent être réexaminées, en prenant en compte les
effets bénéfiques potentiels d’un haut niveau d’ingestion de nitrate.
Nitric oxide synthesis resulting from arginine oxidation has been well
characterised. We have been examining the possibility that nitric oxide can
be generated by sequential reduction of inorganic nitrate in healthy humans.
Dietary nitrate in humans comes mainly from green vegetables and drinking
water. Following absorbtion from the stomach and upper small intestine it
is concentrated in saliva approximately 10 fold. Salivary nitrate is rapidly
reduced to nitrite following contact with bacteria which inhabit the dorsal
surface of the tongue. These bacteria are facultative anaerobes which use
nitrate as a terminal electron acceptor instead of oxygen. This results in
high concentrations of nitrite in saliva which, when swallowed, is acidified
in the stomach. Acidification of nitrite results in the production of nitrous
acid which spontaneously decomposes to form very high concentrations of nitric
oxide. We have termed this mechanism "enterosalivary circulation of nitrate"
Following ingestion of 2mMoles of nitrate (the amount in 50g of lettuce),
nitric oxide concentrations rise from a baseline of 15ppm to a peak of approximately
100ppm. If the nitate is given as lettuce, the rise in nitric oxide concentration
is in the stomach headspace gas is much higher, with value up to 400ppm in
some subjects. This concentration
of nitric oxide is toxic to a large number of microorganisms.
We have evidence that the purpose of intragastric nitric oxide synthesis
is to protect against swallowed gut pathogens, but also may have a role in
maintaining gastric mucosal blood flow. A large number of human gut pathogens,
including E. Coli and Salmonella are killed by nitric oxide generated from
nitrite and acid. Preliminary results in humans exposed to contaminated environments
suggest that a high nitrate intake may protect against infection from infected
food and water.
We have also shown that nitric oxide production from the skin is due to
nitrate and nitrite reduction, rather than from arginine oxidation, again
this may be important in protection from infection. We have shown that nitrite
from saliva, when applied to the skin causes the generation of large amounts
of nitric oxide and we postulate that nitric oxide produced during licking
of wounds may have an antimicrobial effect through this mechanism
More recently we have studied the effect of organic acids and nitrite application
to diseased human skin and found this combination to be effective in curing
a variety of infectious skin diseases.
From these studies we have gained a new perspective on inorganic nitrite
and human health. Rather than being a "pollutant" or toxic substance,
it now seems likely that dietary nitrate is an essential component of a healthy
diet which will protect us against a variety of infectious diseases. Recent
studies have confirmed that individuals who consume more nitrate are also
less likely to develop cancer. The danger to young infants of high nitrate
concentrations in water have probably
been overestimated.
In conclusion, the regulations which limit the amounts of nitrate in food
and drinking water need to be reassessed, taking into account the potential
benefits of a high nitrate intake.
Professeur Martine KAMMERER
Laboratoire de toxicologie
animale et environnementale
Ecole nationale vétérinaire
de Nantes
POTENTIALITE DES NITRATES POUR LES ANIMAUX DOMESTIQUES
Ou
Quelle
toxicité chez l'animal ?
Plan
de l'exposé
1. Les accidents de méthémoglobinémie
liés au nitrate rencontrés chez lesanimaux domestiques
2. Quels effets à long terme_?
2.1 Observations
sur le terrain (bibliographiques et personnelles)
2.2 Etudes expérimentales
2.2.1 Données
bibliographiques
- sur les rongeurs
de laboratoire
- sur les animaux
domestiques
2.2.2 Essais
réalisés à l'ENVN sur le lapin
3. Une évaluation particulièrement difficile
Conclusion
La toxicité aiguë de l'ion nitrate est
bien connue des vétérinaires, mais elle s'exerce dans des conditions bien
différentes de ce qui est observé dans l'espèce humaine. En effet, la méthémoglobinémie
est observée essentiellement chez les ruminants adultes, principalement les
bovins, lorsqu'ils consomment, non pas de l'eau mais des fourrages très riches
en nitrate (au moins 5000 ppm/MS). La physiologie digestive très particulière
des ruminants permet une réduction massive de l'ion nitrate en nitrite grâce
aux microorganismes du rumen, et donc un effet méthémoglobinisant rapide qui
est souvent fatal. Mais les très jeunes ruminants, contrairement aux enfants
en bas âge, ne constituent pas une population particulièrement vulnérable
et peuvent être nourris par du lait reconstitué préparé avec de l'eau riche
en nitrate sans effets défavorables. Cette bonne tolérance est vraisemblablement
à mettre en relation avec l'efficacité des enzymes permettant la réduction
de la méthémoglobine dans les globules rouges du veau. Chez les autres espèces,
la question du risque pour les nouveau-nés ne se pose pas, car ils sont nourris
par le lait maternel très pauvre en nitrate.
Les risques à moyen ou long terme d'une
teneur en nitrate excessive dans l'alimentation et surtout l'eau d'abreuvement,
sont en revanche encore mal précisés. Sur le terrain, un certain nombre d'observations
chez des animaux de rente consommant de l'eau renfermant quelques centaines
de mg/L de nitrate évoquent un effet défavorable sur la croissance, la fertilité
ou la résistance aux infections. Cependant, ces suspicions épidémiologiques
ne sont pas confirmées par les études expérimentales.
Ces études ont été réalisées principalement
chez les rongeurs de laboratoire, le plus souvent chez le rat. Un effet néfaste
sur la croissance est bien retrouvé, mais avec des posologies quotidiennes
très élevées, supérieures à 500 mg/kg PV. Des effets antivitaminiques A et
E ont aussi été observés, ainsi qu'une action hypothyroãdienne qui s'expliquerait
par la perturbation du métabolisme de l'iode.
Ces effets défavorables ont été également
mis en évidence chez diverses spèces d'animaux domestiques, avec une concentration
dans la ration nettement supérieure cependant à celle que l'on peut relever
sur le terrain dans le contexte de pollution de l'environnement que nous connaissons.
Chez les ruminants, la part de l'eau d'abreuvement dans l'apport de nitrate
est très minoritaire par rapport à celle de la ration fourragère. Une augmentation
discrète de sa concentration ne modifie pas de façon sensible l'apport global.
De plus, cet apport étant fractionné, il ne conduit pas à une résorption importante
de nitrites en raison de leur réduction subséquente en ammoniaque et protéines
par la microflore ruminale. Si les ruminants représentent une population à
risques en matière d'intoxication aiguë, ils semblent en revanche être peu
concernés par les effets à long terme.
Les volailles tolèrent également une concentration
élevée dans la ration ou l'eau de boisson. C'est chez le porc que la tolérance
semble moins bonne, et la pollution de l'eau est parfois mise en cause dans
le développement des infections urinaires. Un éventuel effet cancérogène n'a
jamais été envisagé à partir d'observations chez les espèces de rente; ce
n'est pas une préoccupation des vétérinaires, car la courte durée de vie de
ces animaux ne permettrait vraisemblablement pas son expression s'il devait
se manifester.
Afin d'apporter une contribution à la
connaissance des effets des nitrates à moyen et long terme, le Laboratoire
de Toxicologie de l'ENVN a conduit (de 1990 à 1995) des études expérimentales
chez le lapin. Plusieurs lots d'animaux ont été abreuvés pendant des périodes
d'environ 6 mois, avec de l'eau renfermant de 120 à 600 mg de nitrate par
litre. Les animaux ont fait l'objet d'examens approfondis portant en particulier
sur la croissance, la reproduction, la teneur en vitamine A hépatique, le
fonctionnement de la thyroïde, la réponse immunitaire. Globalement, les essais
ont révélé la bonne tolérance des lapins aux concentrations testées.
Il faut souligner cependant les difficultés
particulières d'évaluation de la toxicité de l'ion nitrate. En effet, l'extrapolation
des résultats expérimentaux aux conditions d'exposition réelles, ne permet
pas de tenir compte de l'intervention des microorganismes contaminant éventuellement
le substrat alimentaire et conduisant à l'apparition de nitrite toxique. D'autre
part, les données expérimentales concernant l'effet methémoglobinisant chez
les nouveau-nés animaux sont malheureusement peu utiles pour évaluer le risque
pour le nourrisson car il semble bien que celui-ci soit plus sensible que
les espèces animales disponibles pour les essais.
Enfin, les essais conduits chez le rat,
de loin les plus nombreux, sont parfois remis en cause pour estimer le risque
chez l'Homme, en raison de la faible élimination salivaire de nitrate/nitrite
chez cette espèce contrairement à ce qui est observé chez l'Homme.
Au bilan, on peut considérer que les effets
néfastes de l'ion nitrate ne se manifestent chez les animaux domestiques qu'à
des posologies élevées, ce qui conduit à tolérer une teneur en nitrate dans
l'eau d'abreuvement des animaux de rente nettement supérieure à la CMA de
l'eau potable, les propositions allant jusqu'à 450 mg/l.
Cette teneur peut être acceptable dans
l'eau de boisson des animaux, mais se révèle en revanche très dangereuse pour
d'autres espèces animales, celles dont c'est le milieu de vie, en particulier
les amphibiens.
Acute nitrate toxicity is well known in veterinary medicine, but circumstances
are not the same as in human. Indeed, methemoglobinemia is observed essentially
in adult ruminant, above all in cattle, after consuming nitrate containing
forage (above 5000 ppm /MS), rarely after contaminated water ingestion. The
anatomy and microflora of ruminant animals allows the in vivo reduction of
nitrate to nitrite and methemoglobinemia fomation occurs rapidly. But very
young cattle, contrary to infants, are not particulary vulnerable and milk
replacer can be prepared with high nitrate water without toxic effects. This
is probably on account of enzyme activity which allows methemoglobin reduction
in calf erythocytes. In other species, risk for newborns is not a problem
because they are given mother milk, which is very poor in nitrate.
On the other hand, mild and long term effects of high nitrate food or water
are still not clearly defined. On the field, detrimental effects on growth,
fertility or immune defences were observed in livestock drinking water containing
several hundred mg/L nitrate. However, these epidemiological suspicions are
not confirmed by experimental studies. These studies have been conducted principaly
in laboratory rodents, often in the rat. Decreased weight gain has been noted,
but with high dosages, above 500 mg/kg/d. Hypovitaminosis A and E has been
described, as also a impairment of thyroid function, which could be related
to disturbance of iodide metabolism. These harmful effets have also been related
in various domestic species, but at nitrate levels in diet really above those
one can observe actually in environmental pollution. For ruminants, drinking
water brings much less nitrate than do forages. A slight increasing of nitrate
concentration in water don't lead to perceptible increase in whole intake.
Moreover, this intake is divided, and therefore don't lead to large resorption
of nitrites, which are reduced in ammonia and proteins by digestive microflora.
In fact, cattle is very susceptible to acute intoxication but not to long
term hazards. Poultry tolerate also high levels of nitrate in drinking water
or food. But pigs should be more sensitive and high nitrate water could promote
urinary infections.
Nitrate ingestion has never been involved in the aetiology of cancer in
livestock, but cancer is very rare in these species, which are slaughtered
after very short life.
In order to contribute to the knowledge of chronic nitrate toxicity, the
Laboratory of Toxicology of ENVN conducted (for 1990 to 1995) experimental
studies in rabbits. Several groups of animals were supplied for about 6 months
with water containing 120 to 600 mg/L nitrate. Growth, reproduction, liver
vitamin A stores, thyroid function, immune response were followed. No detrimental
effect was observed.
Evaluation of nitrate toxicity is however difficult, because experimental
results don't take into account microorganisms which can be present in water
or food, and which are able to reduce nitrate to nitrite. Moreover, these
studies are not interesting in order to evaluate risk for baby, who should
develop methemoglobinemia more quickly than animal species. In other respects,
studies in rat with the object of risk assessment in human are sometimes controverted,
because elimination of nitrate/nitrite in saliva is much lower in rat than
in human.
In domestic animals, it is possible to tolerate nitrate concentration in
drinking water higher than what is accepted in human. Proposed values can
reach 450 mg/L.
This level is acceptable for drinking water but could be very dangerous
for animals wich live in water, especially amphibians.
Principales références bibliographiques
ADAMS AW. 1974 - Effects of nitrate in drinking water in japanese quail
Poultry Sci 48, 1222-1229
ALAVANTIC D., SUNJEVARIC I., PECEVSKI J., BOZIN D., CEROVIC G. 1988 – In
vivo genotoxicity of nitrates and nitrites in germ cells of male mice 1.
Evidence for gonadal exposure and lack of heritable effects. Mutat Res 204, 689-695
ANONYME 1998 - Système d'évaluation de
la qualité de l'eau des cours d'eau .
Les études des Agences de l'eau n¯ 64
- Ministère de l'Aménagement du Territoire et de l'Environnement , Direction
de l'Eau - Paris
BERENDE PLM., TERLUIN RW., VAN DER WAL P. 1979 - High doses of nitrate
in rations for milk-fed calves. Z Tierphysiol Tierer
NÑhrg u. Futtermittelkde
42, 312-321
BRUNNING-FANN cs;, KANEENE JB. 1993 - The effects of nitrate, nitrite and
N-nitroso compounds on animal health. Vet Hum Toxicol 35, 237-253
GREEN LC., TANNENBAUM SR., GOLDMAN P. 1982 - Nitrate in human and canine
milk
N Eng J Med 306, 22, 1367-1368
GRUENER N., SHUVAL HI., BEHROOZI K., COHEN S., SCHECHTER H. 1973 - Methemoglobinemia
induced by transplacental passage of nitrites in rats Bull Environ Contamin
Toxicol 9, 1, 44-48
JAHREIS G., HESSE V., SCHONE F., HENNING A., GRUHN K. 1986 - Effect of
chronic dietary nitrate and different iodine supply on porcine thyroid function,
somatomedin-C-level and growth
Exp Clin Endocrinol 88, 242-248
KAMMERER M. SILIART B. 1993 - Toxicité
à moyen terme des nitrates : Evaluation expérimentale des effets sur les fonctions
de reproduction chez la lapine Ann
Rech Vet 24, 434-444
KAMMERER M., PINAULT L. 1998 - Effect of added drinking water nitrate on
the vitamine A status of rabbits. Vet Human Toxicol 40, 197-199
LHUISSIER M., SUSCHETET M., CAUSERET J.
1976 - Influence des nitrites et des nitrates sur certains aspects de l'état
de nutrition vitaminique Ann Nutr
Alim 30, 847-858
MARCO A.,QUILCHANO C.,BLAUSTEIN AR. 1999 - Sensitivity to nitrate andnitrite
in pond-breeding amphibians from the pacific northwest USA. Environ Toxicol
Chem 18, 2836-2839
ROUSE JD., BISHOP CA., STRUGER J. 1999 - Nitrogen pollution : An assessment
of its threat to amphibian survival. Environ Health Perspect 107, 799-803
SORENSEN MT., JENSEN BB., POULSEN HD. 1994 - Nitrate and pig manure in
drinking water to early weaned piglets and growing pigs Livestock Production Science 39, 223-227
SMITH JE., BEUTLER E. 1966 - Reduced diphosphorydine nucelotide dependant
diaphorase in f_tal, newborn and adult calves Nature 13, 5050, 756-757
YERUHAM I.,SHLOSBERG A.,HANJI V., BELLAICHE M., MARCUS., LIBERBOIM M. 1997
- Nitrate toxicosis in beef and dairy cattle herds due to contamination
of drinking water an whey. Vet Human Toxicol
39, 296-298
Docteur Jean-Marc LACORTE
INSERM
Maître de conférences
Universitaire
Praticien Hospitalier
Assistance Publique
des Hôpitaux de Paris
Nitrates
et alimentation : le nitrate dans l'alimentation, bon ou mauvais ? Effets
fruits et légumes : arguments épidémiologiques et biologiques
Un certain nombre
de pathologies comme le cancer ou les maladies cardio-vasculaires ont dans
leur genèse à la fois une part génétique et une part liée à l'environnement,
qui peuvent d'ailleurs influer l'une sur l'autre. Depuis les années 1970 et
les études épidémiologiques de Keys comparant la fréquence des accidents cardio-vasculaires
dans différentes populations et leur alimentation, est né le concept du régime
méditerranéen. Ainsi, il a été mesuré qu’un régime riche en fruits et légumes,
associant des acides gras polyinsaturés et une ration calorique globalement
plus faible pouvait diminuer le risque de maladies cardio-vasculaires par
4 en Grèce par rapport aux Etats-unis. Depuis, de très nombreuses études portant
tant sur la maladie athéromateuse que sur les cancers ont confirmé ces résultats.
Dès lors, l’on a cherché à identifier quels constituants pouvaient être responsables
de ces effets protecteurs et par quels mécanismes. Il apparaît démontré que
pour l’essentiel, c’est le rôle antioxydant de vitamines (C, A et E) et de
certains micronutriments comme les polyphénols présents en grande quantité
dans les végétaux qui jouent un rôle bénéfique pour la santé. Ces résultats
ont conduit certains à développer des études afin de mesurer l’effet de ces
molécules apportées isolément et en supplémentation dans l’alimentation. Force
est de constater que pratiquement aucune ne montre aujourd’hui un effet préventif.
Actuellement, une vaste étude française, SU.VI.MAX, tente d’évaluer l’efficacité
d’une supplémentation en vitamines antioxydantes et en minéraux à des doses
nutritionnelles, mais ne sera exploitable qu’à partir de 2002. Toutefois,
quels que soient les résultats et sans qu’il soit nécessaire, en particulier
dans nos pays à haut niveau de vie, de recourir à une alimentation substitutive,
il apparaît qu’une alimentation variée et riche en fruits et légumes permet
de diminuer le risque de survenue de cancer, de maladies cardio-vasculaire
ainsi qu’un meilleur contrôle de la tension artériel, de l’obésité et du diabète.
Cependant n’oublions pas que ces effets actuellement démontrés résultent d’une
« exposition » sur plusieurs dizaines d’années. Aura-t-on dans 20
ans les mêmes résultats si l’environnement se modifie ?
Professeur Marian APFELBAUM
Faculté de médecine
Xavier BICHAT
PARIS
Perspectives
de sécurité sanitaire
et
gestion des risques
Comme nous le
verrons au cours du colloque, les données historiques, l’expérimentation animale,
l’expérimentation aiguë humaine, et l’épidémiologie permettent de conclure
que la consommation de nitrates est inoffensive chez l’homme sans limite de
dose. Seule, une erreur d’interprétation ancienne d’un demi- siècle, et depuis unanimement reconnue comme
telle, est à l’origine d’une réglementation internationale, européenne et
française sur la teneur en nitrates des eaux de boisson, totalement inadéquate à la réalité scientifique.
Cette réglementation
comporte de surcroît une contradiction interne : tous les légumes contiennent
de fortes quantités de nitrates, approximativement 2 grammes par kilo dans
la laitue, les épinards, la betterave ; bien davantage dans les navets,
la scarole ; moins dans d’autres légumes. Or, la consommation de légumes
est recommandée, à la suite de travaux épidémiologiques
dont les résultats sont convergents, par
les diverses instances, les mêmes qui déclarent l’eau de
boisson dangereuse au dessus de 50 milligrammes par litre.
Ce colloque est
une véritable expérience en termes de gestion de risques : nous aurons
à dire que le roi est tout nu, que la réglementation est absurde en matière
de nitrates, et que donc elle devrait être abolie, alors que l’opinion publique, et donc le monde politique, réclament
davantage de réglementation dans le domaine alimentaire.
Nous nous trouvons
devant une alternative : soit le monde est convaincu par notre discours,
et les réglementations abolies au
nom de la vérité scientifique ; soit, il ne se passera rien, au nom
de la sécurité politique …..
As we shall see during this symposium, the data of history together with
animal experimentation, acute human experimentation and epidemiology as well,
all allow the conclusion that consumption
of nitrates is harmless in Man, with no dose limitation.. Only a half century
old error in interpretation, now unanimously recognised as such, gave birth
to a series of international, European, and French regulations on the level
of nitrates allowed in drinking water, even though they are totally inadequate
in regard of scientific reality.
The regulation comprises a further internal contradiction: all vegetables
contain great quantities of nitrates, about 2 g per kilo in lettuce, spinach
or beet; still more in turnips and endive; somewhat less in other vegetables.
Yet, consuming vegetables is strongly
recommended, according to the convergent results of epidemiological studies,
this recommendation being stated by those same authorities which declare drinking
water dangerous above 50 mg per litre.
This symposium is a veritable experiment in terms of risk management: we
are going to say that the King is naked, that the regulation on nitrates is
absurd, that it should be suppressed, all this while Public Opinion and therefore
the political world are calling for till more regulations in the field of
alimentary safety. We are thus faced with an alternative: either the world
is convinced by what we say, , and the regulation abolished in the name of
scientific truth; or, nothing at all happens, in the name of political security.
Table
Ronde
Animée par les professeurs
Marian APFELBAUM, Nigel BENJAMIN, Christian CABROL et Maurice TUBIANA
Quel
impact sanitaire pour les nitrates ?
Quelle
alimentation préconiser ?
MODULE
2
NITRATES CYCLE BIOLOGIQUE
ET ENVIRONNEMENT
Présidents
de séance :
Docteur Max THIBAULT :
Association
pour la promotion, l'Etude et la Protection des Ecosystèmes Aquatiques – FOUGERE
Monsieur Jean-François PROUST :
Comité Economique
Régional Agricole "Fruits et Légumes" CERAFEL - Morlaix
Monsieur Guy BARROIN
Chargé de Recherches
- INRA
Station d'hydrobiologie
lacustre de Thonon Les Bains
Phosphore,
Azote et dégradation des eaux douces
C’est à partir
des substances minérales dissoutes dans l’eau que les algues synthétisent
leurs tissus. Du point de vue de la structure, le carbone est le composant
principal, venant bien sûr après l’hydrogène et l’oxygène. Mais c’est le phosphore
qui, en conditions naturelles, est le tout premier nutriment à faire défaut
pour assurer la synthèse de nouveaux tissus., avant l’azote et le carbone.
Le phosphore est dit « facteur limitant », notion empruntée à l’agronomie.
C’est également le facteur de maitrise
puisque c’est en agissant sur lui qu’il est possible d’augmenter ou de réduire
les proliférations algales.
En déversant
dans le réseau hydrographique des quantités considérables de phosphore, les
activités humaines, qu’elles soient domestiques, industrielles ou agricoles,
lui font perdre son statut de facteur limitant au profit de l’azote. Cette
situation de carence azotée stimule la prolifération d’algues particulières
(cyanobactéries) capables de fixer l’azote moléculaire dont l’atmosphère constitue
une réserve quasi inépuisable. Une fois métabolisé cet azote se retrouve dans
le milieu aquatique et participe à son fonctionnement au même titre que les
autres apports. D’autres espèces cyanobactériennes vont également se développer
en raison cette fois-ci de leur aptitude à proliférer dans les conditions
d’éclairement réduit qu’entraîne la prolifération algale, toutes espèces confondues.
Outre leurs remarquables
facultés d’adaptation, les cyanobactéries ont une taille, une consistance
et une toxicité qui empêchent les prédateurs potentiels (zooplancton herbivore)
de les consommer. Elles finissent donc par dominer le peuplement algal modifiant
le fonctionnement du réseau trophique au point de nuire aux divers usages
attendus de l’eau : le développement de conditions anoxiques entraîne
l’élimination de toutes les formes supérieures de la vie, à commencer par
les poissons de qualité (salmonidés), l’anoxie de l’interface eau/sédiment
entraîne la réduction des composés du fer et le relargage du phosphore qu’ils
piégeaient lequel vient s’ajouter aux apports du bassin versant pour intensifier
le processus de dégradation, l’envahissement de la colonne d’eau par les cyanobactéries
pose de gros problèmes de qualité d’eau, la présence de toxines cyanobactériennes
n’étant pas des moindres.
Cette inéluctable
dégradation en réponse à la pollution par les phosphates se manifeste d’autant
plus intensément que le caractère stagnant des eaux est prononcé. Il ne faudrait
cependant pas utiliser cette influence primordiale de la stagnation du milieu
pour réserver un traitement préférentiel à des zones dites « vulnérables »,
abandonnant le reste du territoire à une pratique de la déphosphatation à
l’économie. En effet, l’extrème solidarité du réseau hydrographique fait que
de telles mesures discriminatoires ne peuvent qu’engendrer la généralisation
de la dégradation des eaux stagnantes ou ralenties selon un gradient amont/aval,
l’aval ultime étant la mer.
En conditions
fortement anthropisées, l’azote
étant facteur limitant des proliférations
algales, leur augmentation peut être obtenue en ajoutant de l’azote, certes,
mais aussi du phosphore du fait de l’apport automatique de l’azote manquant
par les cyanobactéries fixatrices d’azote. Quant à vouloir ramener les proliférations
algales au voisinage de ce qu’elles étaient avant la pollution par les phosphates
(quand le phosphore était limitant), seule peut y arriver une réduction du
phosphore, vouloir intervenir sur l’azote nécessiterait de le rendre plus
limitant que le phosphore à un niveau de concentrations proche du naturel.
Sans doute la pollution par les phosphates fait-elle de l’azote
le facteur limitant, mais c’est toujours le phosphore qui est le facteur de maitrise.
Lutter contre
les nitrates pour résoudre le problème de l’eutrophisation est donc une solution
à la fois pratiquement impossible (nécessité de rendre l’azote plus limitant
que le phosphore au voisinage des concentrations naturelles), écologiquement
dangereuse (stimulation des cyanobactéries), techniquement inefficace (réinjection
automatique par les cyanobactéries de l’azote que l’on s’efforce d’éliminer)
et rationnellement indéfendable (on propose de lutter contre la pollution
par les phosphates en traquant les nitrates !)
Non seulement
les nitrates ne sont pas la bonne cible mais leur présence contribue à traiter
deux conséquences néfastes de la pollution par les phosphates : leur
azote remonte le rapport N/P empêchant ainsi l’apparition des fixatrices d’azote,
leur oxygène entretient l’oxydation des composés du fer à l’interface eau/sédiment
empêchant ainsi le relargage du phosphore associé.
En fait, si l’azote
entraîne des nuisances dans les milieux aquatiques, ce n’est pas pour son
rôle « eutrophisant » à l’état nitrique mais pour sa toxicité à
l’état ammoniacal. En effet, en plus de la consommation d’oxygène qu’entraîne
la nitrification de l’azote ammoniacal, celui-ci est toxique sous sa forme
non dissociée NH3. En conditions naturelles, les risques de toxicité
sont très faibles car les concentrations d’azote ammoniacal le sont également.
Par contre, en conditions anthropisées, les risques augmentent considérablement
par suite des multiples déversements d’effluents peu ou pas traités contenant
cette forme d’azote, dans les urines notamment. De plus, l’accroissement du
pH favorisant la forme NH3 toxique, les eaux les plus touchées
sont celles où la photosynthèse, consommatrice de CO2, est la plus
active, donc celles où les algues proliférent le plus et par conséquent celles
où le phosphore est le plus abondant.
Pour
en savoir plus
BARROIN
G.,
1985 - La dénitrification en milieu lentique. - Rev. fr. sci. eau, 4, p. 79-92.
(251)
BARROIN
G.,
1990 - La pollution des eaux par les phosphates. La Recherche, 221, p. 620-627.
(367)
BARROIN
G.,
1991 - La réhabilitation des plans d'eau. La Recherche, 238, p. 1412-1422.
(414)
BARROIN
G.,
1995 - Les phosphates ou comment manipuler la science. La Recherche 281, 56-60.
BARROIN
G.,
DORIOZ, J.M., DURAND P., MEROT P., 1997 - Entraînement de l’azote dans les
eaux de surface et conséquences sur les écosystèmes aquatiques. Colloque «maîtrise
de l’azote dans les agrosystèmes » Reims, 19-20 nov. 1996. Ed. INRA.
Les Colloques n° 83, 39-53.
ATELIERS THEMATIQUES
Ateliers 1 :
Docteur Jean-Luc BURGAUD
Société NICOX
Dérivés
nitrés en Pharmacie
Assises Internationales
ENVIROBIO: 13-14 novembre 2000 – Paris
Dr. J.L. Burgaud, NicOx, B.P. 313,
1900 route des crêtes, 06906 Sophia-Antipolis.
NicOx est une société biopharmaceutique qui développe de nouveaux produits
avec des profils de sécurité et d’efficacité améliorés par l’exploitation
des propriétés de monoxyde d’azote (NO). L’approche innovante de NicOx consiste
à exploiter les propriétés bénéfiques du NO en greffant sur des médicaments
existants une structure libérant de l’oxyde nitrique dans les tissus et le
sang de façon prolongée et contrôlée. L’objectif du développement de ces molécules
chimiques est triple:
- diminuer les effets
secondaires des anti-inflammatoires non-stéroïdiens (AINS) notamment au niveau
du tractus gastro-intestinal et rénal,
- améliorer le profil
pharmacologique de ces substances, et enfin,
- obtenir de nouveaux
effets pharmacologiques et donc de nouvelles applications thérapeutiques.
L’exposé portera sur la présentation
des avantages d’une telle stratégie en s’appuyant sur les résultats obtenus
avec le produit phare de NicOx, la nitro-aspirine ou NCX 4016.
Cette nouvelle entité
chimique est un dérivé nitré de l’Aspirine. La molécule est composée de l’acide
acétylsalicylique, d’un pont chimique estérifié et d’une entité capable de
libéré du NO (ONO2) par hydrolyse enzymatique du pont chimique
(1). Cette structure ne peut donc en aucun cas être considéré comme une pro-drogue,
le NO comme l’aspirine possédant une activité pharmacologique. On parle donc
d’une nouvelle entité chimique.
Le premier aspect de cette présentation
concernera la pharmacocinétique du produit. La demi-vie de l’acide acétylsalicylique
étant très courte et le produit étant difficilement dosable, nous suivons
donc le devenir du NCX 4016 en dosant au niveau sanguin le taux de ces 2 principaux
métabolites, l’acide salicylique et les nitrites/nitrates. Nous observons,
quelque soit le composé dosé, une homologie dans les tracés. En effet, les
pics sériques du salicylate et des nitrates apparaissent dans un délai de
6 heures tandis que les nitrites sont absents (2). On note ici l’importance
de la libération lente du ONO2, qui évite une augmentation rapide
du taux plasmatique de NO, ce qui aurait pour conséquence, comme nous le verrons
plus loin, d’entraîner une vasodilatation massive responsable d’une hypotension.
Afin de vérifier que le ONO2
libère correctement du NO, nous avons mesurer ex vivo le taux de GMP cyclique
intraplaquettaire. Nous constatons ici que le taux augmente lentement, mimant
parfaitement les courbes des nitrates.
Nous avons bien entendu
comparer la cinétique du NCX 4016 à celle d’un donneur conventionnel de NO,
la S-nitroso-N-acétyl-penicillamine sur des monocytes humains. Nous avons
ainsi constaté et confirmé la libération lente et prolongée du NO pour le
NCX 4016 tandis que le SNAP montre une libération beaucoup plus rapide et
beaucoup plus massive de NO. Cette constatation s’avère confirmée que l’on
regarde l’évolution du taux des nitrates, du taux de GMP cyclique intracellulaire
ou l’apparition intracellulaire de fluorescence en utilisant la technique
du DAF-2DA (3).
Des études de pharmacocinétique nous
ont également permis d’élucider une partie du processus métabolique propre
à nos composés. L’administration orale d’une dose unique de 200 mg/kg de NCX
4016 chez le rat a permis de montrer la formation de HB-NO (nitroso-hémoglobine);
cette formation étant maximale à 6 heures et disparaissant après 24 heures.
La concentration
maximale de salicylates atteinte est de 8 mg/ml. Cette concentration plasmatique est dans tous les cas supérieure aux
concentrations effectives du composé obtenues dans différents modèles expérimentaux.
Au niveau du tractus gastro-intestinal,
de nombreuses études ont démontré que l’utilisation d’AINS représentait un
facteur d’aggression notamment pour la muqueuse gastrique. Ceci s’explique
par le fait que les AINS inhibent totalement la synthèse de prostaglandines
au niveau de l’estomac. Il en résulte une diminution de flux sanguin engendrant
ainsi une baisse de la production de bicarbonate et du mucus. Il en découle
obligatoirement une lésion de la muqueuse gastrique (4).
Bien que les NO-AINS inhibent la synthèse de prostaglandines, ils permettent,
par l’effet du NO, de maintenir la sécrétion de bicarbonate et de mucus, évitant
ainsi la lésion de la muqueuse gastrique. Cette protection du tractus gastro-intestinal
se retrouve également lorsque nous comparons les effets des NO-AINS
avec ceux des inhibiteurs spécifiques de la COX-2 chez l’animal âgé, les NO-AINS
démontrant des effets plus bénéfiques (5).
Le deuxième objectif du développement
des NO-AINS est d’améliorer les effets pharmacologiques des produits. Nous
avons donc comparer les effets pharmacodynamiques de NCX 4016 à ceux de l’aspirine.
Ces études ont porté sur les effets anti-inflammatoires, analgésiques, anti-thrombotiques
et anti-prolifératifs de ces deux composés. Dans tous les cas la nitro-aspirine
s’est révélé un composé plus efficace que l’aspirine:
- dans un modèle expérimental d’inflammation
in vivo, le NCX 4016 montre un effet anti-inflammatoire 10 fois supérieur
à celui du composé natif,
- le NCX 4016 a montré également une
plus grande efficacité que l’aspirine à prévenir le thromboembolisme chez
la souris. Cet effet s’explique en majorité par l’action du NO au niveau des
plaquettes, une augmentation prolongée du taux de GMP cyclique dans celles-ci
étant responsable de l’inhibition de l’agregation et de l’adhesion plaquettaire,
l’aspirine étant dépourvue d’activité sur l’adhésion plaquettaire.
En résumé, la nitro-aspirine
joue donc un rôle primordial au niveau du système cardio-vasculaire. De part
ses actions combinées aspirine et NO, elle permet d’inhiber la vasoconstriction,
la dégranulation des mastocytes, l’agrégation et l’adhésion plaquettaire,
la migration des neutrophiles et des lymphocytes, l’infiltration des macrophages
et enfin diminuer le chimiotactisme pour les neutrophiles (6).
De plus, des études
complémentaires ont permis de confirmer que le NCX 4016 inhibe la prolifération
des cellules musculaire lisses vasculaires, démontrant ainsi un intérêt thérapeutique
potentiel pour le traitement de la sténose après angioplastie. Ce dernier
phénomène trouve une explication dans la faculté que possède NO-aspirine à
inhiber la translocation nucléaire du facteur de transcription NF-kB (7).
Mais le portefeuille
de produits en développement chez NicOx ne s’arrête pas à la nitro-aspirine.
Il comprend des futurs médicaments pour le traitement de nombreuses pathologies.
On compte parmi ces produits le HCT 1026, un dérivé nitré de l’AINS flurbiprofène,
qui est en essai clinique de phase II pour deux affections fréquentes ches
la femme ménopausée, l’incontinence urinaire et l’ostéoporose. Une première
étude pilote de phase II a démontré une amélioration des paramètres urodynamiques
et des symptomes cliniques associés à une vessie neurogène. De plus, le développement
clinique d’une formulation pour usage local du HCT 1026 pour des affections
dermatologiques telles que le psoriasis et la dermatite atopique est en cours.
Le NCX 1015 est un dérivé nitré du stéroïde prednisolone. Cette molécule est
en phase de développement pour le traitement des entéropathies inflammatoires
chroniques. Il a été démontré sur des modèles animaux que le NCX 1015 est
plus efficace dans la diminution de l’inflammation des tissus que les stéroïdes
conventionnels. De plus, NicOx évalue actuellement NCX 1020 et d’autres NO-stéroïdes
pour le traitement des maladies respiratoires telles que l’asthme. Des résultats
préliminaires ont démontré, sur différents modèles animaux, une plus grande
activité bronchodilatatrice du NCX 1020 comparativement au composé parent.
On compte parmi les
produits phare de NicOx le NCX 701, dérivé du paracetamol. La greffe d’un
molécule de monoxyde d’azote à ce produit permet de le doter d’une activité
analgésique plus puissante, ce produit possède en outre une activité anti-inflammatoire
contrairement au produit parent. De plus, des études précliniques ont démontré
une réduction de la toxicité hépatique et rénale (8).
Tous ces exemples
montrent l’intérêt grandissant de l’utilisation du monoxyde d’azote dans l’industrie
pharmaceutique. Les produits développés par NicOx sont un exemple de l’utilisation
possible des nitrates pour obtenir un effet bénéfiques sur l’organisme. Cette
notion est la parfaite application au niveau industriel de la découverte des
Professeurs Ignarro, Murad et Furchgott, Lauréat du Prix Nobel en 1998
pour leur recherche sur le monoxyde d’azote comme importante molécule
messager dans l’organisme.
References
1- NO-aspirins, a class of new anti-inflammatory and
antithrombotic agents.
Del
Soldato P. Sorrentino R. and Pinto A.
Trends Pharmacol. Sci. 1999: Aug.: 20(8). 319-323
2-
EPR analysis of nitrosyl-hemoglobin, an unequivocal marker of nitric oxide
release from NO-NSAIDs in vitro
and in vivo.
Aldini G., Carini M., Stefani R., Maffei
Facino R., Rossoni G. and Del Soldato P.
Presented at
the 11th International Conference on Advances in Prostaglandin
and Leukotriene Research. Florence, Italy. June 4-8, 2000.3-
No-Aspirin inhibits IL-1b-converting Enzyme (ICE) and Prevents IL-1b,
IL-I8 and IFNg release
from Endotoxin-stimulated Human Peripheral Blood Monocytes.
Fiorucci S., Santucci L., Del Soldato
P., Morelli A.
J.
Immunol., 2000. In Press.
4-
Lack of gastric toxicity of nitric oxide-releasing aspirin, NCX 4016, in the
stomach of diabetic rats.
Tashima K., Fujita A., Umeda M., Takeuchi
K.
Life
Sciences, 2000. Aug. 18; 67(13): 1339-52
5-
Nitric Oxide: implications for therapeutic breakthroughs.
Burgaud, J.L., Del Soldato P.
ID
Weekly Highlights, Current Drugs Ltd., August 2000
6-
Myocardial protection by the nitroderivative of aspirin, NCX 4016: in vitro and in vivo experiments in the rabbit.
Rossoni G., Berti M., De Gennaro Colonna
V., Bernareggi M., Del Soldato P. and Berti F.
Ital.
Heart J. 2000. Feb. 1(2); 146-55.
7-
NO-aspirin protects from T cell-mediated
liver injury by inhibiting caspase-dependent processing of Th1-like cytokines.
Fiorucci S., Santucci L., Antonelli E., Distrutti E., Del Sero G., Morelli O.,
Romani L., Federici B., Del Soldato P., Morelli A.
Gastroenterology
2000. Feb; 118(2): 404-21
8-
Nitroparacetamol exhibits anti-inflammatory and anti-nociceptive activity.
al-Swayeh OA., Futter LE., Clifford RH.
and Moore P.K.
Br. J. Pharmacol. 2000. 130: 1453-1456
Pour étudier les
effets pharmacologiques, pharmacodynamiques et pharmacocinétiques de ses produits,
NicOx collabore dans le monde entier avec des chercheurs reconnus pour leur
compétence qui guident et conseillent la société dans ses programmes de recherche
et de développement. Parmi ces nombreux collaborateurs, plus de cent au total,
nous pouvons noter les Professeurs Ignarro* (UCLA Medical College, USA), Samuelson*
(Karolinska Institute, Sweden), Moncada (Wolfson Institute, UK), Flower (William
Harvey Research Insitute, UK), Hawkey (University Hospital Nottingham, UK),
Paoletti (University of Milan, Italy), Emery (University Hospital Leeds, UK),
Wallace (University of Calgary, Canada), Benjamin (Queen’s College Londres,
UK). * Lauréat du Prix Nobel.
NicOx is a biopharmaceutical company
developing innovative new drugs designed to have improved safety and efficacy
profiles through the application of the recently discovered properties of
nitric oxide (NO). The Company is at the forefront in the research and development
of nitric-oxide-releasing therapeutics. The Company is targeting major pharmaceutical
markets including pain and inflammation and a broad range of other therapeutic
categories, including cardiovascular diseases, respiratory diseases, inflammatory
bowel disease, urinary incontinence, osteoporosis, Alzheimer’s disease and
glaucoma.
Nitric oxide, a compound that usually takes the form of an odorless,
colorless gas, is synthesized in the cells of mammals and is believed to be
involved in a broad range of biochemical and physiological reactions. Scientific
research, including recent groundbreaking studies for which three scientists
(including a member of the Company’s Scientific Advisory Board) were awarded
the 1998 Nobel Prize in Physiology or Medicine, has shown nitric oxide not
only to convey biochemical signals that result in a wide spectrum of effects
on different biological systems, including the cardiovascular, central nervous
and immune systems, but also to act as an important regulator of general cellular
processes. These findings indicate the potential for nitric oxide to play
a role in the discovery of breakthrough drugs for a wide variety of diseases
that may not only have fewer side effects than existing products, but also
may be more effective. Using its proprietary technology, the Company seeks
to exploit this potential through the development of nitric-oxide-releasing
therapeutics.
The Company’s innovative
approach harnesses the beneficial properties of nitric oxide by grafting a
nitric-oxide-releasing structure onto existing drugs. By beginning with a
conventional drug whose pharmacological properties are well known, the NicOx
benefits from an existing base of knowledge from which to design preclinical
and clinical development studies. This enables evidence of efficacy and reduced
side effects to be confirmed very early in clinical development, and in some
cases by the end of Phase I, thereby shortening the overall product development
cycle. In preclinical tests, the Company’s drug candidates have shown dramatically
reduced side effect profiles compared with the parent drugs, and in many cases
show the potential to be more effective. Furthermore, the Company has already
achieved proof of principle in humans for one of its lead nitric-oxide-releasing
compounds. At present, three drug candidates have advanced to human clinical
trials.
The Company is focusing
on the development of nitric-oxide-releasing derivatives of aspirin and non-steroidal
anti-inflammatory drugs (NSAIDs) such as flurbiprofen. More than 30 million
people worldwide consume NSAIDs every day. The major drawback of NSAIDs and
aspirin is their tendency to cause gastrointestinal damage. Gastrointestinal
toxicity from NSAIDs is estimated to be the most frequent drug side effect
in the United States, and almost 25% of the anti-ulcer drug market has been
estimated to be aimed at treating this side effect. The recently introduced
COX2 selective NSAIDs have gained significant market share, but concerns remaining
regarding the theoretical side-effects of the selective inhibition including
renal toxicity, edema, hypertension and thrombosis . Preclinical research by
the Company has shown that grafting a nitric-oxide-releasing structure onto
aspirin and a range of NSAIDs may greatly reduce their gastrointestinal, renal
and cardiovascular adverse effects and increase their safety in frequent use
conditions and situations of pre-existing gastrointestinal damage. The Company’s
preclinical research also suggests that the anti-thrombotic properties of
nitric oxide may significantly enhance the effectiveness of aspirin in the
prevention of cardiovascular disease. Furthermore, the Company’s nitric oxide
releasing NSAIDs may be suitable for new indications including incontinence,
osteoporosis, Alzheimer’s disease and prevention of colon cancer.
The Company is developing NCX 4016 (NO-aspirin) for the treatment of cardiovascular
disease and pain and inflammation. Its IND (Investigational New Drug) application
was approved by the FDA (Food and Drug Administration), allowing for future
clinical trials of the compound in the United States.
The most advanced of these drug candidates is HCT 1026 (NO-flurbiprofen),
currently in phase II clinical development for urinary incontinence and Paget’s
disease, a disease that can lead to osteoporosis. In parallel, the Company
is developing a broad range of uses for other nitric-oxide-releasing NSAIDs
as new treatments in important pharmaceutical growth markets, including asthma,
inflammatory bowel disease, urinary incontinence, osteoporosis, Alzheimer’s
disease and glaucoma. The Company plans to advance clinical development of
these drug candidates on its own, with a view to negotiating further strategic
partnerships based on such drugs at later stages in the development process.
Other important drug candidates in
the Company’s pipeline include nitric-oxide-releasing drugs to treat a range
of indications, including nitric oxide releasing steroid derivatives for the
treatment of inflammatory bowel disease
and respiratory diseases such as asthma. The Company has also recently advanced
into the development of the lead compounds NCX 2216 from a new series of nitric
oxide releasing anti-inflammatory compounds with potent anti-oxidant properties
for the treatment of Alzheimer’s disease. For the treatment of asthma, the
Company is developing NCX 950, a nitric oxide releasing beta agonist. NCX
904, a nitric oxide releasing beta antagonist is in development for the treatment
of glaucoma. In addition to the drug candidates already in its development
pipeline, the Company believes its nitric-oxide-releasing technology has potential
applications in far-ranging fields that the Company has identified for future
study.
Atelier 2
Monsieur Jacques POULET
Union des industries de la fertilisation
Fertilisation
et environnement : Union des Industries des fertilisants et Amendements
Atelier n° 2 : Fertilisation
et environnement. (Unifa).
Aujourd’hui, l’agriculteur est confronté à
plusieurs défis. Le plus ancien, partagé par tous, et sûrement le plus important
est de pouvoir vivre de son métier. Les politiques agricoles communes successives
ont en général répondu à cette préoccupation. Par contre, la dernière « PAC »,
Agenda 2000, change complètement la donne. Il est prévu une baisse du revenu
de l’agriculteur d’environ 15% sur les cinq ou six prochaines années. L’agriculteur
doit donc repenser son métier en terme de compétitivité.
Le
second challenge de l’agriculteur consiste à fournir des produits de qualité
à des prix concurrentiels. Ce principe, qui semble être une exigence nouvelle
des consommateurs, est en fait le moteur d’une agriculture de progrès qui
a probablement conduit à certains des excès que nous connaissons aujourd’hui.
La forte médiatisation des événements qui touchent actuellement l’agriculture
(OGM, ESB, etc) a annihilé, chez le citoyen, tout jugement critique et rationnel
au profit de réactions épidermiques et émotives. L’agriculteur doit communiquer
pour faire connaître son métier.
Enfin, le dernier défi est peut-être né des
succès que l’agriculteur a remportés sur les deux précédents. Auparavant « nourrisseur »
de ces concitoyens, l’agriculteur devient « pollueur » de notre
environnement. Etonnant pour une profession proche de la nature dont le crédo
est de transmettre à la génération suivante un patrimoine (le sol, la ressource
en eau, le cheptel, etc.) intact sinon amélioré. Désormais l’agriculteur doit
prendre en compte l’impact de ses activités sur l’environnement.
La
vie de l’industrie des fertilisants est très liée à cette évolution. Hier
associée à la réussite de l’agriculture pour nourrir la planète et aux gains
de compétitivité de notre secteur agricole, l’industrie des fertilisants se
retrouve aujourd’hui au premier rang des accusés à travers l’utilisation des
fertilisants minéraux. Les discours extrémistes de certains occultent totalement
l’importance vitale pour notre agriculture d’une fertilisation minérale qui
malgré toutes les hypothèses restera nécessaire. Les industriels, en relation
avec les instituts techniques, ont donc mis en place des expérimentations
et développé des outils de gestion de la fertilisation minérale. L’objectif
est triple : optimiser l’utilisation de la fertilisation minérale, limiter
les risques pour l’environnement et garder, voire améliorer la qualité de
la production.
Cet atelier vous propose trois présentations
succinctes, ayant pour thème principal l’azote, pour illustrer ces propos :
- L’industrie des fertilisants, le cycle de l’azote,
le bilan azoté.
Une agriculture durable va de paire avec l’utilisation
des fertilisants minéraux azotés. Quel tonnage représentent ces fertilisants
azotés ? Comment fabrique-t-on un fertilisant azoté ? Quelles sont
les autres sources d’azote disponibles pour la plante ? Voici quelques-uns
uns des points qui seront présentés avant d’avoir un aperçu rapide du cycle
de l’azote en agriculture et du « bilan azoté » pour mieux comprendre
toute la difficulté que représente la gestion de la fertilisation azotée.
L’utilisation de plus en plus courante du « bilan azoté »
accompagnée d’outils d’aide à la décision permet d’ajuster au mieux la fertilisation
minérale aux besoins de la plante. Si malgré toutes les précautions prises,
un accident climatique, phytosanitaire, etc, aboutissait à un reliquat d’azote
élevé dans le sol, il existe des méthodes pour piéger ces nitrates et limiter
le risque de transfert vers les nappes phréatiques.
- Les outils de gestion de la fertilisation azotée :
un exemple, le chlorophylomètre.
Pour minimiser le stock de nitrates dans le sol après
la récolte, il faut raisonner sa fertilisation azotée. Cela consiste à alimenter
sans excès la culture durant son cycle de végétation sans pour cela avoir
une incidence négative sur son potentiel de rendement. L’objectif des outils
de pilotage de la fertilisation azotée est de réduire le plus possible le
reliquat azoté provenant des fertilisants minéraux. Ces outils mesurent la
teneur en azote de la plante. L’outil présenté par Hydro Agri France est un
chlorophylomètre (Hydro-N tester) capable d’aider l’agriculteur dans sa prise
de décision en fonction du rendement optimal à atteindre mais aussi en fonction
d’objectif de qualité du produit à récolter.
3.
Un exemple
de mesure pour limiter l’impact de la fertilisation azotée sur l’environnement :
le bassin versant d’Aradé.
Depuis 1980, dans la région de
Toulouse, un dispositif expérimental à grande échelle a été mis en place
par Grande Paroisse, premier fabricant de fertilisants en France, en association
étroite avec les agriculteurs: le bassin versant d’Auradé. Cette expérimentation
a mis en évidence une relation de cause à effet entre pratiques des agriculteurs,
pluviométrie et concentration en nitrates des eaux, et un lien entre structure géographique du terrain
et dynamique de l’azote. Des mesures ont été retenues et appliquées sur l’ensemble
du dispositif : des mesures préventives concernent la gestion des cultures
et une conduite raisonnée de la fertilisation azotée et des mesures curatives
consistent à aménager le paysage agricole pour réduire le risque de transfert
de nitrates vers les eaux de surface.
MODULE
2 bis
NITRATES CYCLE BIOLOGIQUE
ET ENVIRONNEMENT
Présidents
de séance :
Monsieur FAVIER :
Ecole Supérieure
Physique Chimie Industrielle - PARIS
Professeur Maria Elvira LOPEZ-MOSQUERA :
Ecole Polytechnique
Supérieure Université de
St Jacques
de Compostelle - LUGO
Professeur
Jean-Claude REMY
Ecole Nationale Supérieure
d'Agronomie – ENSAM – Montpellier
Le
cycle biogéochimique de l'azote
L'azote est largement présent dans tous les compartiments de la planète
et notamment dans la biosphère continentale dans laquelle il est stocké dans
la matière organique des sols. L'azote est présent naturellement tant à l'état
solide dans les matières organiques vivantes et mortes que sous la forme liquide
en solution, qu' à l'état gazeux dans l'atmosphère.
En l'absence de tout apport par l'homme, l'azote contenu dans la biosphère
est issu majoritairement de la fixation biologique par les fixateurs libres
ou symbiotiques. Les pertes concernent alors essentiellement la lixiviation
des nitrates mais aussi surtout les pertes gazeuses sans lesquelles l'azote
se serait accumulé à la surface du sol, dans la matière organique.
Afin de stimuler la production primaire des plantes non symbiotiques
l'homme a cherché à accroître la quantité d'azote minéral mis en jeu dans
les cycles culturaux soit par des apports organiques en utilisant la capacité
de minéralisation du sol, soit en apportant directement la forme utilisable
par les végétaux, c'est à dire le nitrate. Les quantités mises en jeu sont
ainsi passées globalement de 100 kg à 300 kg. Une telle démarche s'accompagne
forcément d'une plus grande difficulté de gestion avec un accroissement du
risque de se retrouver en situation d'excès quelle que soit la forme d'azote
minérale ou organique apportée.
L'azote minéral ou organique est présent naturellement dans les sols
et les eaux depuis toujours. Seul l'excès est redouté et bien entendu la définition
et l'acceptation de seuils font l'objet d'âpres débats. Le principe de précaution,
appliqué à la teneur en nitrate de l'eau potable, a conduit à l'adoption du
seuil de 50 mg de NO3/l, compromis entre les risques toxicologiques encourus
par les consommateurs et la faisabilité d'une gestion durable et viable des
agrosystèmes par les agriculteurs.
Les dispositifs réglementaires étant fixés, c'est à l'agronome de trouver
les solutions techniques capables de produire en quantité et en qualité tout
en préservant les ressources naturelles, notamment la qualité de l'eau.
Nitrogen is globally present in all the planet compartments.
Continental biosphere contains the major part of nitrogen in the soil organic
matter. Nitrogen is present at solid state in leaving and dead organic matter,
at liquid state in soil, rivers and lakes solution as well as at gaseous state
in the atmosphere.
If man does not add nitrogen artificially, the content
of the biosphere is mainly coming from free
or symbiotic biological fixation. Lost of nitrogen is the fact of two processes.
The first is leaching toward ground water and sea. The second is denitrification
to the atmosphere, phenomenon without which nitrogen should be accumulated
in soil organic matter at the soil surface.
According to the objective to increase primary production,
man has attempt to increase the quantity of mineral nitrogen in soil, by the
way of organic manure in the first time and directly by nitrate supply in
the second time. The annual budget of mineral nitrogen is now near 300 kg
of nitrogen instead of about 100 kg initially. This change induce naturally
larger difficulties to manage nitrogen securely without lost.
Mineral nitrogen is naturally present in the biosphere.
It is not a xenobiotic element. However, only the excess is damaging. The
threshold of 50 mg NO3 per litre is a reasonable compromise between health
risks and an acceptable constraint in a productive and sustainable agrosystem
management.
Regulations in this matter are now adopted. The agronomist
must found the technical solutions for promoting new agricultural systems
economically efficient, safe for the health and respectful of the environment.
Docteur Max THIBAULT
Association pour la
promotion, l'étude et la protection
des écosystèmes aquatiques
– FOUGERE
Eco-histoire
: évolution de la qualité des eaux : exemple des rivières à saumon en Bretagne
depuis l'ancien régime
En utilisant le Saumon atlantique comme
indicateur des relations entre les activités humaines et l'écosystème fluvial,
un bilan de l'évolution de la qualité de l'eau des cours d'eau bretons à saumon
est dressé dans une perspective historique sur une durée de près de six siècles,
du XVème à la fin du XXème siècle. Ce travail a eu pour but de tester un des
aspects de l'hypothèse d'une abondance passée extraordinaire du saumon dans
cette province sous l'Ancien Régime, admise sans hésitation depuis le début
du XXème siècle.
Il s'agit essentiellement d'un travail
bibliographique, de culture scientifique, employant quelques résultats du
milieu du XXème siècle concernant les pollutions d'activités anciennes, rouissage
du lin et du chanvre, tanneries. Deux autres activités sont aussi prises en
compte, les moulins à papier et les mines de plomb argentifère. Cette étude
repose sur une méthode en quatre points incluant la dimension historique :
* les connaissances actuelles
de l'écologie de l'espèce et de sa répartition en Bretagne, passée (au début
du XVIIIème siècle) et présente, localisent l'étude quasi-exclusivement à
la moitié occidentale de la péninsule armoricaine. Les fleuves côtiers de
la moitié orientale, à l'exception du Couesnon, n'ayant pas été colonisés
par le saumon.
* une approche transdisciplinaire,
avec mise en concordance, dans le temps et dans l'espace, sur les bassins
versants de ces cours d'eau, des travaux d'historiens, avec des documents
bruts de l'époque, en y intégrant les mesures réglementaires.
* un retour systématique
aux sources originales. Ce dernier point constitue le socle de cette étude.
Il s'appuie sur les dépouillements des documents d'archives, d'ouvrages, de
rapports officiels, d'articles.
C'est surtout la pollution provenant
de la pratique du rouissage dans les cours d'eau et des effluents des mines
de plomb argentifère qui est connue. Les pollutions issues des effluents des
tanneries et des moulins à papier sont, aussi, comme le rouissage, des pollutions
organiques et physiques, mais plus localisées. Ces quatre activités étudiées
concernant l'ensemble des cours d'eau à saumon, sauf pour les tanneries qui
ne se rapportent qu'au Finistère.
* elles se répartissent
préférentiellement dans un large quart nord-ouest de la Bretagne et à l'est.
* elles montrent un accroissement
depuis le XVème siècle, pour atteindre un apogée du milieu du XVIIIème siècle
au milieu du XIXème siècle, et décliner ensuite, puis disparaître, à quelques
décennies près, au milieu du XXème siècle.
L'hypothèse est émise d'une pollution
croissante entre le XVème siècle et le milieu du XVIIIème siècle, d'un apogée
de cette pollution jusqu'au milieu du XIXème siècle, en relation avec l'évolution
économique de ces activités. La Bretagne a compté parmi les plus grandes provinces
toilières de France et a même figuré à leur tête à la fin du XVIIIème siècle
; les mines de plomb argentifère sont une des plus importantes du royaume
au cours de la seconde moitié du XVIIIème siècle. L'importance de la pollution
est connue des contemporains : la couleur jaune de l'eau des rivières suite
au rouissage, la mortalité des poissons et des hommes (dysenterie, saturnisme,
pouvant expliquer la surmortalité bretonne observée à la fin du XVIIIème siècle),
et la destruction de la végétation (les arbres morts à 15 m sur chaque rive
en aval de l'effluent des mines de Basse-Bretagne).
Les mesures réglementaires ne concernent
que le rouissage dans les cours d'eau. Elles existent depuis les coutumes
(jusqu'au décret de 1958) et n'ont jamais été réellement appliquées. Le prix
de vente plus élevé des toiles provenant du rouissage en eau courante, de
meilleure qualité, a toujours constitué un élément prépondérant par rapport
à la qualité de eau.
Une conclusion en trois points se dégage
:
* Force est de constater
que ce n'est pas la réglementation qui a entraîné, sinon l'arrêt, tout au
moins une diminution de la pollution due au rouissage, mais l'arrêt de cette
activité qui a conduit à l'absence de réglementation.
* L'abondance passée extraordinaire
du saumon en Bretagne sous l'Ancien Régime est un mythe. Ceci s'appuie sur
une quasi-stabilité des zones de production depuis le début du XVIIIème siècle
et sur les pollutions croissantes mises en évidence principalement sur les
fleuves côtiers bretons du quart nord-ouest et à l'est de la province.
* La césure du milieu du
XXème siècle consacre la fin d'activités anciennes et le développement de
quatre éléments, la croissance urbaine, la généralisation de l'adduction d'eau,
l'intensification de l'agriculture, l'évolution des soucis d'hygiène de la
fin du XIXème siècle vers les soucis de santé qui émergent à la fin du XXème
siècle.
The Atlantic Salmon is used as an indicator
of the links between human activities and the river ecosystem. This permits
to sum up through nearly six centuries, from the 15th to the end
of the 20th century, the evolution of the water quality of the
Briton salmon rivers. This article aims at testing one of the aspects of the
hypothesis concerning an extraordinary abundance of salmons in this area in
the Ancien Régime, hypothesis that has been admitted, without check, since
the beginning of the 20th century.
Work is based on several scientific writings,
and uses a few results of the middle 20th century concerning pollution
from ancient activities, retting of flax and hemp, tanning. Two other activities
are also taken into account, production in paper water mills and argentiferous
lead mines. This study lies on a four-point method that includes an historical
dimension:
·
What is known about the ecology
of the species and its repartition in Brittany, passed (beginning of the 18th
century) and present focuses the study quite exclusively on the Western part
of Brittany. Coastal rivers of the Eastern part _ except for the Couesnon
river_ have not been colonised by the Salmon.
·
An approach through different fields,
linking both in space and time works of Historians on the water sheds of these
streams with original documents, including statutory measures of that time.
·
A systematic check back to the sources
of data. That point represents the cornerstone of this study. It backs on
reading recorded documents, books, official reports, and articles.
Pollution from retting in rivers and from
producing argentiferous lead is well known. However, pollution from tanning
and the one that derives from paper water mills is also an organic and physical
pollution, but more localised. These four activities concern all of the Salmon
streams, except for tanneries that were only found in the Finistère area.
·
These four activities are mainly
found in a large NorthWestern part and in the Eastern part of Brittany.
·
They grew from the 15th
century up to the middle 18th-middle 19th centuries,
and then fell to disappear in the middle of the 20th century.
One hypothesis is that pollution grew
between the 15th century and the mid 18th century. Pollution
reached a peak until the mid 19th century because of the economic
evolution of these activities. Brittany used to be one of the biggest areas
that produced canvas in France and was even heading at the end of the 18th
century. Brittany’s argentiferous lead mines are among the biggest ones of
the whole kingdom in the second half of the 18th century. The importance
of pollution was well known at that time. Proves were the yellow colour given
to the river water by retting, fish and people mortality (because of dysentery,
saturnism, that could explain the high mortality in Brittany at the end of
the 18th century), and the destruction of vegetation (e.g. dead
trees were found up to 15 m from both banks downstream of the sewage of Basse-Bretagne
mines.
Statutory measures only concern retting
in streams. They had been existing since the French coutumes (local rules
from the Middle Age until the 1958 decret) and have never really been applied.
The higher sale price of canvas retted in running water, thus giving a better
quality, has always been determining in the quality of water.
A three-point conclusion arises:
·
Regulation did not entail the stop
or at least less pollution from retting, but the death of this activity did
entail a situation of no regulation.
·
The presumed passed abundance of
salmons in Brittany in the Ancien Régime is a myth, based on a quasi-stability
of the production areas since the beginning of the 18th century
and on the growing pollution observed mainly on the coastal rivers in the
North West and on the East of Brittany.
·
The mid 20th century
represents a break with the end of ancient activities and the development
of four elements, i.e. urban growth, a generalised water adduction, an intensified
agriculture, the evolution of hygienic cares at the end of the 19th
century and a growing interest in health considerations at the end of the
20th century.
Professeur
Sybil SEITZINGER
Institute of Marine and Coastal
Sciences – Rutgers University
New Brunswick – New Jersey
– USA
Madame Carolien KROEZE
Environmentale Systems Analysis Group
Wageningen University – NETHERLAND
Transport
de Nitrates par les rivières vers les écosystèmes côtiers
Human activities have markedly increased nitrogen (N) inputs to terrestrial
ecosystems. A portion of this nitrogen enters rivers and downstream coastal
ecosystems resulting in coastal eutrophication and increased greenhouse gas
production. The magnitude and spatial
variability in N inputs to coastal ecosystems globally is related to the spatial
distribution of human population, agriculture, and fossil fuel combustion,
based on the N-Model. Coastal ecosystems
in the Northern Hemisphere receive approximately 90% of the global dissolved
inorganic N (DIN = nitrate+ammonia) transported by rivers(~21 Tg N/y). About
45% of global DIN export is from watersheds in India, China and Southeast
Asia. European rivers draining into the Northeastern Atlantic and European
Seas (Baltic, Mediterranean, Black) carry approximately 20% of DIN exported
by rivers globally, although they account for only 10% of the global exoreic
area. Synthetic N fertilizer use and
NOy atmospheric deposition in these European watersheds is ~20-25% of global
use/deposition; human sewage is ~12% of the global total. The Mediterranean
region has the lowest areal based N inputs to watersheds (1005 kg N/km2)
from these three sources, while the North Atlantic region has the highest
(4300 kg N/km2), with intermediate rates in the Black Sea (2800
kg N/ km2) and Baltic region (1800 kg N/ km2). As a result, DIN export by rivers from the
North Atlantic region (990 kg N/ km2) is almost three times the
export from the Black or Baltic region, and almost eight times greater than
from the Mediterranean region. In the coming decades, substantial increases
in N export are predicted in many world regions due to continued increases
in food production and consumption, and industrialization. By the year 2050,
DIN inputs are estimated to more than double globally, with largest absolute
increases predicted for Asia, and large relative increases in Africa and South
America.
Not all nitrogen forms contribute equally to coastal
eutrophication. Dissolved inorganic
N often accounts for only half of the N entering coastal ecosystems; organic
N, in both particulate and dissolved forms, comprises the remainder. Only a portion of this organic nitrogen is
biologically available on the time scales relevant to many coastal ecosystems.
A portion of the nitrogen entering rivers and coastal
ecosystems is permanently removed by denitrification. Based on the RivR-N model, approximately 40% to 75% of the N input
to 16 rivers in the eastern U.S. is removed within the river during transport.
A further ~20% to 70% of the N input to estuaries is removed by denitrification.
Water residence time is an important factor controlling the proportion of
N removed in both rivers and estuaries.
An additional impact of the increased input of anthropogenic
N is increased production of nitrous oxide (N2O), a green house
gas that is involved in stratospheric ozone destruction. Nitrous oxide emissions from rivers and coastal
marine ecosystems associated with anthropogenic N inputs are estimated to
account for approx. 25% of total global anthropogenic N2O emissions;
by the year 2050 these aquatic emissions are predicted to more than triple.
An open dialog among scientists, policymakers and nitrogen producers and users
is needed to optimize nitrogen management in food and energy production and
environmental protection in the coming decades.
Les
transferts des nitrates par les rivières aux écosystèmes côtiers : effets
de l’occupation des sols et des transformations dans les rivières.
Sybil P. Seitzinger, Rutgers University, Institute of Marine and Coastal
Sciences, New Brunswick, NJ, USA.
Carolien Kroeze, Environmental
Systems Analysis Group, Departement of Environnemental Sciences, Wageningen
University, Wageningen, the Netherlands
Les activités humaines ont sérieusement
augmenté les apports d’azote aux écosystèmes terrestres. Une part de cet azote
rejoint les rivières et l’aval des écosystèmes côtiers, ce qui entraîne une
eutrophisation des côtes et une production accrue de gaz à effet de serre.
L’importance et la variabilité spatiale
des apports d’azote aux écosystèmes côtiers sont liées aux distributions spatiales
de population humaine, d’agriculture, de combustion de carburant fossile,
à partir du modèle de l’azote. Les écosystèmes de l’hémisphère Nord reçoivent
environ 90 % de l’azote minéral dissout (DIN = Nitrate + ammoniaque) transporté
par les rivières (environ
21 t N/an). Environ 45 % de ces DIN exportés proviennent des bassins indiens,
chinois et d’Asie du Sud.
Les rivières européennes se rejetant dans
le Nord Est de l’Océan Atlantique et dans les mers européennes (mer baltique,
méditerranéenne et noire) charrient environ 20 % des DIN rejetés par les rivières,
bien qu’elles rentrent en ligne de compte pour seulement 10 % des terres émergées.
L’usage de fertilisant minéral et les dépôts atmosphériques (NOy) dans ces
bassins européens est de l’ordre de 20-25 % de l’usage et des dépôts atmosphériques
totaux.
Les rejets humains représentent environ
12 % du bilan total. Les régions méditerranéennes connaissent le taux le plus
bas d’intrant azoté, soit 1 005 kg N/km2 de bassin à partir de
ces trois origines, tandis que la région Nord Atlantique connaît le niveau
le plus élevé (4 300 kg N/km2), alors que le niveau intermédiaire
est dans la mer Noire (2 800 kg N/km2) et la région baltique (18
kg N/ha). Ainsi, DIN reçues par les rivières du Nord Atlantique sont trois
fois plus élevées que celles des régions baltiques ou de la mer Noire et 8
fois plus fortes que les régions méditerranéennes.
Dans les décades à venir, des augmentations
substantielles dues à l’augmentation continuelle des productions agricoles,
de la consommation et de l’industrialisation. A l’horizon 2050, les estimations
donnent un doublement des intrants de DIN, avec la plus grande évolution prévue
pour l’Asie, mais également de relativement grande augmentations pour l’Afrique
et l’Amérique du Sud.
Toutes les formes
de le l’azote ne contribuent pas de façon analogue à l’eutrophisation L’azote
minéral ne représente généralement que seulement la moitié de l’azote en jeu
dans les écosystèmes côtiers ; l’azote organique, tant sous forme particulaire
que dissoute, représente le complément. Seule une part de cet azote organique
est biologiquement disponible à l’échelle de temps appropriée aux écosystèmes
côtiers.
Une fraction de l’azote rejeté dans les
rivières et dans les écosystèmes côtiers est constamment perdu par dénitrification.
Sur la Base du modèle RivR-N, près de 40% à75% du N rejeté dans 16 rivières
de l’Est des Etats Unis, est perdu par la rivière, durant le transfert. La
dénitrification dans les estuaires contribuerait à éliminer 20% à70% de l’azote
qu’ils reçoivent. Le temps de résidence de l’eau est un facteur déterminant
dans le contrôle de l’azote éliminé, tant dans les rivières que dans les estuaires.
Un impact complémentaire de l’augmentation
de l’azote d’origine humaine porte sur l’augmentation de l’émission d’oxyde
nitreux (N2O), un gaz à effet de serre qui est impliqué dans la
destruction de l’ozone stratosphérique. Les émissions de ce gaz provenant
des rivières et des écosystèmes marins côtiers, associées aux apports d’azote
liés aux activités humaines sont estimés représenter environ 25% des émissions
totales de N2O ; à l’horizon 2050, ces émissions aquatiques
devraient tripler. Un dialogue ouvert regroupant les scientifiques, les producteurs
et les utilisateurs d’azote et les instances chargées de la politique réglementaire
est nécessaire pour améliorer la gestion de l’azote dans les productions agricoles
et énergétiques, et dans la protection de l’environnement pour les décennies
à venir.
Monsieur J-P FAILLAT
Laboratoire d'hydrogéologie,
ISAMOR-UBO
Technopôle Brest-Iroise
– PLOUZANE
Dénitrification
biologique naturelle dans les
eaux
souterraines : modes d'occurrence et conséquences pratiques
La dénitrification
biologique naturelle dans les eaux souterraines : modes d'occurrence et conséquences
pratiques.
Les
problèmes d’ordre à la fois quantitatif et qualitatif posés par l’utilisation
des eaux en Bretagne constituent d’ores et déjà un facteur limitant dans l’utilisation
des ressources en eau de cette région et son essor économique. En particulier,
les concentrations excessives en nitrates entraînent l’abandon de nombreux
captages. Cependant, des forages d’exploitation profonds, pouvant dépasser
la centaine de mètres, donnent des eaux dépourvues de nitrates, dans un environnement
où cet ion est abondant dans les captages par puits, par sources aménagées,
voire dans certains forages tout aussi profonds. Une explication à cette apparente
incohérence a été recherchée par des études détaillées, dans le périmètre
expérimental de Kerveldréac’h (PEK) en Finistère, de 0,35 km2,
sur schiste, et dans celui de Maupertuis (PEM) en Côte d’Armor, de 0,17 km2,
sur granite. Ces études font ressortir la forte influence des conditions redox
et hydrodynamiques dans l’élimination des nitrates par dénitrification biologique
naturelle en profondeur, au delà de 30-40 m dans les schistes, et à peine
un peu plus bas dans les granites, ce qui aboutit à une zonation hydrochimique
verticale des nappes de fissures. Cette zonation peut être masquée par le
fonctionnement interne des forages, phénomène dont la non prise en compte
dans l’évaluation de la représentativité des échantillons peut biaiser considérablement
les interprétations. Afin de vérifier l'hypothèse d'une dénitrification biologique
profonde, les microflores bactériennes dénitrifiantes hétérotrophes et autotrophes
(Thiobacillus denitrificans) ont été quantifiées. Le phénomène de dénitrification,
qui a donc un rôle central, est connu dans les sols depuis longtemps
et a été souvent étudié depuis le début des années soixante dix dans
les nappes d’interstices ou de fissures et chenaux des aquifères de bassins
sédimentaires, ce qui a donné lieu à des synthèses. Il a été bien moins abordé
en milieu uniquement fissuré de socles éruptifs et métamorphiques, à relativement
faible perméabilité dans l’ensemble, ce qui est le cas du Massif Armoricain.
Les deux grands types de roches, schistes et granites, qui représentent l’essentiel
des aquifères de cette région ayant montré la même disposition, il est licite
d’envisager que cela soit la règle. Par conséquent, on peut envisager de trouver
à peu près partout des eaux relativement profondes sans nitrates, mais contenant
fréquemment du fer et du manganèse. Il n’en reste pas moins que la partie
supérieure des nappes de fissures, nitratée, participe largement aux écoulement
de surface, ce qui rend indispensable le contrôle des apports en nitrates
et introduit des retards entre les actions de remédiation et les effets escomptés
(quelques années).
A study of the organisation
and functioning of a hydrogeological system in a fractured aquifer in crystalline
rocks was undertaken in the Kerharo river basin in Brittany (Finistère, France).
Observations and measurements were made from the scale of the river basin
to that of a 0.35 km2 experimental perimeter with more than 50
water sampling points. A several method approach revealed some aspects of
the geometry of the aquifer (heterogeneity, anisotropy, connectivity, partitioning)
and provided information about the hydrodynamic situation and especially the
hydrochemical functioning of the aquifer. Redox and hydrodynamic conditions
control vertical stratification through the position of the oxido-reduction
zone between a thin oxidizing zone containing nitrate and a nitrate-free reducing
zone. The bacteriological approach suggest that the site potential in terms
of denitrifying processes would be apparently associated to the heterotrophic
part of the bacterial communities. The autotroph fraction (Thiobacillus denitrificans) is found at
lower densities and is merely linked to surfaces. However, the occurrence
of these two types of microflore in all of the six studied systems confirm
that denitrifying processes can develop provided environmental conditions
allow. The possibility of extension of this scheme to others aquifers is examined.
Key words :
Fractured medium, nitrate, denitrification, denitrifying bacteria, hydrogeochemical
zoning, Finistère, Brittany.
Monsieur Pierre CASTILLON et Monsieur Gilles THEVENET
ITCF – Institut Technique
des Céréales et des Fourrages – PARIS
Rôle
des systèmes de cultures dans le transfert
de
nitrate vers les aquifères récepteurs
Dans tous les écosystèmes, la dynamique
de l'azote conduit à la présence de nitrate dans les sols. Qu'il provienne
des engrais minéraux ou de la minéralisation de l'azote organique, une partie
peut être transférée vers les eaux de surface ou souterraines qui approvisionnent
les captages d'eau potable.
Faibles en général dans les écosystèmes
naturels (forêts, pelouses de montagne … etc) les transferts de nitrate, du
sol vers les aquifères récepteurs, sont parfois importants dans les sols cultivés
et d'autant plus que l'agriculture est intensive. Celle ci utilise souvent
des quantités importantes de fertilisants azotés qui se sont ainsi vu imputer
la responsabilité principale de l'accroissement des teneurs en nitrate des
eaux. Le mot engrais est alors devenu synonyme de pollution. Or l'azote minéral
présent dans le sol à la récolte des cultures, et donc susceptible d'être
entraîné par les eaux de drainage ou de ruissellement, ne contient qu'une
très faible part des engrais minéraux apportés, sauf lorsque la fertilisation
est excessive par rapport aux stricts besoins des cultures. Néanmoins la réglementation
qui s'applique aux zones vulnérables depuis la mise en œuvre de la directive
nitrate concerne principalement les pratiques de fertilisation azotée des
cultures.
Les fuites de nitrate des parcelles agricoles
sont en réalité beaucoup plus le fait des systèmes de cultures pratiqués que
de leur fertilisation azotée. La nature des espèces cultivées et leur mode
de succession dans les rotations culturales déterminent l'époque et la durée
des intercultures au cours desquelles l'ion nitrate présent, ou produit dans
le sol par la minéralisation des matières organiques, est susceptible d'être
drainé. Dans un contexte pédoclimatique donné, la quantité de nitrate transférée
vers les aquifères est d'autant plus élevée qu’est longue la durée de la saison
pluvieuse pendant laquelle le sol est dépourvu de couvert apte à y puiser de l’azote .
Toutefois indépendamment de l'époque et
de la durée du cycle végétatif de la culture, la quantité d'azote nitrique
perdue par un sol cultivé, c'est à dire non récupérable par les cultures ultérieures,
peut aussi varier selon l'espèce cultivée en relation avec certaines de ses
caractéristiques : profondeur d'enracinement, aptitude à puiser l'eau dans
le sol, teneur en azote des résidus de culture … etc. C'est ainsi que les
pertes d'azote sont en général beaucoup plus élevées après un maïs qu'après
un sorgho dont les cycles végétatifs sont pourtant concomitants. Il en est
de même pour les cultures de pois et d'orge de printemps, les fuites d'azote
nitrique étant généralement plus importantes après la culture de pois qui
ne reçoit jamais de fertilisation azotée.
L'occupation permanente
du sol par un couvert végétal constitue
la solution idéale pour limiter au minimum les pertes d'azote des systèmes
cultivés. La prairie qui en est l'exemple type n'exclut pourtant pas le drainage
du nitrate , en quantités parfois importantes. Ceci est particulièrement vrai
pour la prairie pâturée dont une part de l'azote que les animaux y restituent
au cours du pâturage est inévitablement drainé. L'importance des pertes d’azote
dépend beaucoup dans ce cas du mode de gestion de la prairie et tout particulièrement
de la part respective de la fauche et de la pâture, ainsi que du chargement
d’animaux au pâturage permis par la croissance de l’herbe. Dans les prairies
de graminées , la suppression de la fertilisation azotée substituée par l'introduction
d'une légumineuse ne modifie en rien le phénomène.
Quelle que soit la nature de l'écosystème,
le transfert de nitrate vers les aquifères récepteurs est donc inéluctable.
Il a pour origine principale la matière organique du sol dont la minéralisation
produit d’autant plus de nitrate que le stock d’azote organique dans le sol
est important. Dans les écosystèmes cultivés, la substitution à la fertilisation
azotée de solutions apparemment plus "écologiques", telles que l'introduction
des légumineuses dans le système de culture, ne modifie pas toujours dans
le sens souhaité le phénomène.
In all ecosystems, nitrogen transformations lead to the presence of nitrate
in soils. Whether it originates from mineral fertiliser or from the mineralisation
of organic nitrogen, part of it may be transferred into surface or underground
waters which supply drinking water catchments.
Although generally low in natural ecosystems (forests, moors, mountain
pastures etc,) nitrate transfers from the soil into aquifers are sometimes
considerable in cultivated soils and especially when farming is more intensive.
In this case large amounts of nitrogen fertilisers are used and these are
therefore blamed for most of the increase in the nitrate content of the water.
The word fertiliser has thus become synonymous with pollution. Yet the mineral
nitrogen present in the soil when the crop is harvested, and thus likely to
be transported in drainage water or runoff only contains a very small proportion
of the mineral fertiliser applied, except when the fertilisation is excessive
compared with the strict requirements of the crops. Nevertheless the regulations
which have applied to the vulnerable zones since the introduction of the Nitrate
Directive in 1991 are mostly concerned with the practice of nitrogen fertilisation
of crops.
The losses of nitrate from agricultural fields are in reality
more the result of the cropping systems practised than of their nitrogen fertilisation. The nature
of the crops grown and their succession in the crop rotation determine the
timing and duration of the periods between crops during which the nitrate
ion present, or produced in the soil by the mineralisation of organic matter,
is likely to be leached. In a given soil/weather situation, the amount of
nitrate transferred into aquifers increases when the period between harvest
and the sowing of the following crop is longer, especially in winter.
However, quite apart from the timing and duration of the growing period
of the crop, the amount of nitrate nitrogen lost from a cultivated soil, i.e.
not retrievable by subsequent crops, can also vary according to the characteristics
of the species grown, such as rooting depth, ability to extract water from
the soil, nitrogen content of the crop residues, etc. Thus nitrogen losses
after maize are generally much higher than after sorghum, although their growing
seasons are concomitant. It is the same for spring-sown peas and barley, the
nitrate nitrogen losses usually being more after the pea crop even though
it never receives any nitrogen fertiliser.
The permanent occupation of the land by vegetation, growing as much as
weather conditions allow, constitutes the ideal solution to restrict to a
minimum the nitrogen losses from cropping systems. Grassland, which is a typical
example, may nevertheless allow leaching of nitrate, sometimes in considerable
quantities. This is particularly true for grazed pastures for which part of
the nitrogen which the animals return to the soil while grazing is unavoidably
leached. The magnitude of the losses depends greatly in this case on how the
pasture is managed, and particularly on the balance between cutting and grazing.
They also depend on the intensity of nitrogen fertilisation which, by increasing
grass growth, increases the stocking density of the grazing animals. To introduce
legumes into pastures as a substitute for nitrogen fertilisation has no effect
on the phenomenon.
Whatever the nature of the ecosystem, the transfer of nitrate into the
aquifer is inescapable. It mainly originates from the soil organic matter
whose mineralisation produces more
nitrate when the amount of organic nitrogen in the soil is greater. In cultivated
ecosystems, replacing nitrogen fertiliser by solutions considered more “ecological”
such as the introduction of legumes into the cropping system, does not always
change the phenomenon in the way it is hoped.
Professeur Thomas ADDISCOTT et Professeur David POWLSON
IACR – Rothamsted
– Harpenden – UK
La dynamique de l'azote dans le sol – Impact des
pratiques agricoles
Pratiquement
toutes les formes d'activité de production aboutissent à des pollutions particulières,
et l'agriculture n'y fait pas exception. Elle entraîne des nitrates et des
phosphates vers les eaux naturelles et des oxydes d'azote gazeux dans l'atmosphère.
Les pertes de nitrate vers les eaux ont provoqué des inquiétudes généralisées
et des dépenses importantes, à la fois des gouvernements et de l'industrie.
Les modes d'exploitation du sol ont des répercussions fortes sur la production
de nitrates dans le sol et la perte de nitrate du sol dans l'air et dans l'eau,
que ces nitrates soit minéralisés dans le sol ou proviennent des engrais.
Les stratégies de gestion des nitrates dans l'environnement dépendent donc
d'une bonne compréhension du comportement des nitrates dans les sols et de
l'influence des pratiques agricoles sur celui-ci. Cet article donne un bref
aperçu de cette compréhension, dans l'état actuel des connaissances.
Le "problème
des nitrates" (Nitrate Problem) qui est le thème central de cette conférence,
est essentiellement un problème de nitrate "inopportun"(untimely)
: le nitrate qui se trouve au mauvais endroit, au mauvais moment. Une grande
partie de ce texte, traitera des raisons pour lesquelles le nitrate est présent
et comment le problème peut être évité. Les nitrates sont présents dans le
sol, parce que ils ont été apportés en tant que fertilisants, ou parce qu'ils
ont été produits par la population microbienne, fongique et d'invertébrés
du sol, et, de plus en plus, parce qu'ils ont été déposés par l'atmosphère.
Les études dans
lesquelles, l'azote des fertilisants est marqué (ou tracé) avec l'isotope
15 de l'azote, montrent qu'environ 70% de l'azote apporté à un blé d'hiver
(normalement près de 200 kg/ha), se retrouvent dans le grain et la paille.
Les chaumes et les racines restant dans le sol ainsi que les exsudats racinaires
contiennent près de 15% de l'engrais sous forme organique. Seulement 1% se
retrouve sous forme minérale (nitrate et ammoniaque), le reste étant perdu
par dénitrification ou lessivage. Le climat détermine quelle voie de perte
prédomine, à chaque saison, mais, en moyenne, près des 2/3 sont perdus par
dénitrification et un tiers par lessivage. Les pertes directes par lessivage
des engrais sont donc relativement faibles, généralement de l'ordre de 5 à
6%. La betterave sucrière est même plus efficace que le blé d'hiver pour la
réduction des pertes de nitrate, mais d'autres cultures, notamment les pommes
de terre, le sont beaucoup moins.
Les entraînements
directs ne sont pas les seuls problèmes. L'azote des engrais, qui reste sous
forme organique, peut éventuellement être reminéralisé, à un moment potentiellement
inopportun. De telles pertes indirectes par lessivage peuvent devenir importantes,
si l'azote des engrais s'accumule dans les résidus organiques pendant une
longue période. Cette accumulation peut également être perçue comme un accroissement
de la fertilité.
La quantité relativement
limitée d'azote lessivé, évoquée pour le blé d'hiver, peut s'accroître sévèrement
si un excès de fertilisant est apporté. Cet aspect, comme la possibilité de
lessivage indirect, suggère qu'une des clés essentielles de la gestion du
problème des nitrates porte sur l'évaluation précise des besoins d'azote.
Ceci est un sujet qui a été abondamment développé, et les modèles informatiques
prennent une part importante et croissante
dans l'aide à la décision de l'application d'engrais.
Les microorganismes
qui sont responsables de la minéralisation de la matière organique du sol,
l'accomplissent quand les conditions leur sont favorables, plutôt que quand
les cultures en ont besoin. Ils apprécient particulièrement les conditions
qu'ils trouvent lorsque le sol réchauffé par l'été, est réhumidifié au début
de l'automne, mais c'est justement à ce moment que le nitrate est le plus
indésirable. Le sol cultivé ne présente pas de végétation à cette période
et la pluie va rapidement percoler à travers le sol pendant quatre à six mois.
Ce nitrate produit naturellement est généralement responsable de la part principale
du nitrate lessivé du sol, plutôt que l'azote des fertilisants apporté au
printemps au cultures en croissance; ainsi, le maintien d'un couvert végétal
et la gestion de la minéralisation sont deux éléments clé supplémentaires
pour régler le problème des nitrates.
La couverture
végétale est plus efficacement assurée avec les prairies, et peu de nitrate
est perdu dans les eaux de drainage, quand l'herbe est exploitée en foin ou
en ensilage, même avec des apports passablement élevés d'engrais azoté. La
prairie est cependant utilisée souvent pour le pâturage, et l'introduction
des animaux rend le système beaucoup moins étanche vis à vis des nitrates.
Ceci s'explique du fait que les animaux pâturent l'essentiel de la surface,
mais excrètent seulement sur quelques secteurs peu étendus créant ainsi des
zones sur lesquelles beaucoup plus d'azote est déposé que les plantes ne peuvent
en absorber. L'excès d'azote dans ces zones, est facilement transformé en
nitrate par la biologie du sol et lessivé.
La couverture
végétale des sols peut être assurée, dans un système de culture en semant,
tôt en saison, des cultures d'hiver. Ceci constitue maintenant une technique
usuelle pour de nombreux agriculteurs, mais elle a été suspectée de transférer
des maladies d'une culture à l'autre. Les "cultures pièges à nitrates"
peuvent aussi être pratiquées pendant l'automne et le début de l'hiver, pour
prélever les nitrates du sol avant leur fuite, mais celles-ci présentent deux
inconvénients. Le premier porte sur l'utilisation de l'eau qui aurait été,
sinon, utilisée par la culture suivante, le second concerne la disponibilité
des nitrates prélevés par les plantes qui, souvent, ne sont pas relargués
assez rapidement pour profiter à la culture suivante, après labour de printemps.
La minéralisation
est un processus entièrement naturel, et elle peut être aménagée seulement
dans certaines limites. Le nitrate est produit dans le sol sans aucune intervention
humaine. Des mesures faites au Centre de Recherche de Rothamsted montrent
que, déjà dans les années 1870, la composition en nitrate des eaux de drainage
d'un sol non cultivé qui n'avait reçu aucune fertilisation depuis au moins
dix ans, dépassait la limite actuelle de 50mg/l. Ce nitrate avait été produit
dans le sol, par la minéralisation de la fraction azotée de la matière organique.
Tout effort de gestion de la minéralisation de l'azote implique évidemment
la limitation des apports de résidus azotés s'accumulant dans le sol, et ceci
peut constituer un des avantages d'applications d'engrais soigneusement ajustées.
Le labour est aussi à prendre en compte, car il peut assurer l'enfouissement
des pailles après récolte.
Le labour est bien connu
pour favoriser la minéralisation du carbone et de l'azote de la matière organique,
dans le sol, en exposant des agrégats du sol, auparavant enfouis, à l'oxygène
et aux microorganismes, et en apportant à ces derniers, de nouvelles sources
d'énergie. Les différents modes de labours varient considérablement sur l'aspect
modification de la structure du sol et sur l'intensité de celle-ci. Ils diffèrent
aussi sur les quantités d'énergie qu'ils apportent au sol. Ces différences
influent sur les microorganismes et les animaux du sol qui effectuent la minéralisation
et qui métabolisent le carbone et l'azote organiques. Il est bien possible
que l'effet général du labour consiste à augmenter l'apport de nitrate dans
le sol, souvent à l'automne quand il est susceptible de se lessiver. Cette
difficulté est levée si le labour incorpore dans le sol, la paille non récoltée
(qui ne doit plus être brûlée en Europe). La paille contient peu d'azote,
et les microorganismes du sol utilisent les ions nitrates, quand ils la dégradent,
réduisant ainsi, la quantité à risque.
Nous pouvons
résumer ce texte, en disant que la gestion du problème des nitrates, consiste
dans des bonnes pratiques agricoles qui limitent les quantités d'azote dans
le sol tout au long des saisons et, spécialement, lors du début de la période
de lessivage hivernal.
Practically all forms of
productive activity lead to pollution of some kind, and farming is no exception.
It loses nitrate and phosphate to natural waters and gaseous nitrogen oxides
to the atmosphere. Losses of nitrate to water have caused widespread concern
and large expenditure by both governments and industry. The way the land is
managed has a strong effect on the production of nitrate in the soil and the
loss of both soil-produced and fertilizer nitrate from the soil to air and
water. Strategies for managing nitrate in the environment therefore depend
on a clear understanding of the behaviour of nitrate in the soil and the influence
on this of agricultural practice. This paper gives a brief account of this
understanding as it stands at present.
The ‘nitrate problem’ with which this conference is concerned
is essentially a problem of untimely
nitrate, nitrate which is in the wrong place at the wrong time. Much of this
paper is concerned with why it is there and how the problem can be avoided.
Nitrate is present in the soil because it has been applied as fertilizer,
because it has been produced by the soil’s population of microbes, fungi and
invertebrates or, increasingly, because it has been deposited from the atmosphere.
Studies in which nitrogen from fertilizer is labelled
(or ‘tagged’) with the isotope 15N show that roughly 70 percent
of the nitrogen (normally about 200 kg/ha) applied to winter wheat crops is
recovered in the harvested grain and straw. Stubble and roots remaining in
the soil together with any material exuded from the roots contain about 15
percent of the fertilizer in organic form. Only one percent remains as mineral
nitrogen (nitrate + ammonium) and the rest is lost by denitrification or leaching.
The weather determines which loss pathway predominates in a particular season
but, on average, about two thirds of the loss is by denitrification and one
third by leaching. Direct leaching losses from fertilizer are therefore relatively
small, commonly as little as 5-6 percent. Sugar beet is even more efficient
than winter wheat at restricting nitrate losses, but some other crops, notably
potatoes, are much less efficient.
Direct leaching losses are not the only problem. The
fertilizer nitrogen, which remains in organic form, will eventually be re-mineralized,
possibly when it is most untimely. Such indirect leaching losses can become
important if fertilizer nitrogen accumulates in organic residues over a long
period of time. This accumulation can, of course, also be regarded as an increase
in soil fertility.
The relatively small direct leaching loss cited for winter
wheat can increase sharply if too much nitrogen fertilizer is applied. This,
together with the possibility of indirect losses, suggests that one of the
keys to managing the nitrate problem is the correct assessment of the amount
of nitrogen needed. This is a topic which has attracted great attention, and
computer models are playing an increasingly important part in decision-support
for fertilizer application.
The microorganisms that are active in mineralizing soil
organic matter do so when the conditions suit them rather than when crops
need nitrogen. They particularly enjoy the conditions which they find when
soil warm from the summer is re-wetted during early autumn, but this is just
when the nitrate they produce is most untimely. Arable soil is bare of vegetation
at that time and rain will soon be percolating through it for four to six
months. This naturally-produced nitrate is usually responsible for a larger
proportion of the nitrate leached from the soil than fertilizer nitrogen applied
to growing crops in spring, so maintaining vegetative cover and managing mineralization
are two further keys to managing the nitrate problem.
Vegetative cover is most effectively maintained in grassland,
and little nitrate is lost in drainage when grass is grown to be harvested
as hay or silage, even with fairly large applications of nitrogen fertilizer.
Grass is, however, commonly used for grazing, and the introduction of animals
makes the system far more leaky with respect to nitrate. This happens because
the animals graze most of the area but excrete on small areas of it, causing
patches on which far more nitrogen is deposited than the grass can absorb.
The surplus nitrogen in these patches is readily converted to nitrate by the
soil population and leached.
Vegetative cover can be extended in arable systems by
sowing winter crops early. This is now standard practice for many farmers,
but it has been suggested to cause diseases to be carried over from one crop
to the next. ‘Catch crops’ can also be grown during autumn and early winter
to pick up nitrate from the soil before it is lost, but these have two problems.
One is that they use water that would otherwise have been available to the
following crop, and the other is that when they are ploughed into the soil
in spring, as usually happens, the nitrate they have trapped is not released
quickly enough to benefit the following crop.
Mineralization is an entirely natural process, and it
can be managed to only a limited extent. Nitrate is produced in the soil without
any human intervention. Measurements made at Rothamsted showed that, even
back in the 1870s, nitrate concentrations in water draining from an unploughed
soil that had received no nitrogen fertilizer for at least ten years exceeded
the present-day EC limit of 50 g m-3. This nitrate was produced
by the mineralization of nitrogen-containing organic matter in the soil. Any
attempt at managing the mineralization of nitrogen clearly involves limiting
the amount of nitrogenous residues accumulating in the soil, and this should
be one of the benefits of carefully-managed fertilizer applications. It can
also involve tillage, which may include the incorporation of straw after harvest.
Tillage is well known to enhance the mineralization of
carbon and nitrogen in organic matter in the soil by exposing previously unexposed
soil surfaces to oxygen and microbes and by providing the latter with new
sources of energy. The various tillage systems differ considerably in the
way they modify the soil structure and the extent to which they do so. They
also differ in the amounts of energy they put into the soil. These differences
have an impact on the microbes and soil animals which bring about mineralization as they metabolize organic carbon
and nitrogen. The overall effect of tillage is likely to be to increase the
amount of nitrate in the soil, often in autumn when it is vulnerable to leaching.
This problem is alleviated if the tillage incorporates unharvested straw (which
can no longer be burnt in Europe) into the soil. Straw contains little nitrogen,
and soil microbes utilize nitrate when they break it down, thereby lessening
the amount at risk.
We can summarize this paper by saying that managing the
nitrate problem is a matter of good agricultural practice which minimizes
the amount of nitrate in the soil throughout the season and especially as
the winter leaching period approaches
Table ronde
animée par :
Professeur Jean-Claude REMY,
Professeur
Elvira LOPEZ MOSQUERA – Monsieur Michel LE ROUX
Nitrates,
activités agricoles, eutrophisation et pollution diffuse ?
MODULE
3
NITRATES ET OPINION PUBLIQUE
- QUELS RISQUES ?
Président
de séance :
Professeur Edmond-Antoine DECAMPS :
Groupe Physique
Environnement – Université de Rennes
Maître Bertrand BURG
Cabinet HUGLO/LEPAGE
– PARIS
Normes,
directives et jurisprudence
QUALITE DE L'EAU ET NITRATES :
ASPECTS JURIDIQUES
La nouvelle directive "eau potable"
n°98/83/CEE du Conseil du 3 novembre 1998, relative à la qualité des eaux
destinées à la consommation humaine, abroge à compter de son entrée en vigueur
la directive n°80/778/CEE.
Toutefois, l'entrée en vigueur de cette
nouvelle directive n'est prévue que cinq ans après son adoption, soit le 3
novembre 2003.
A compter de cette date, les Etats membres
disposeront d'un délai de deux ans pour transposer les dispositions de cette
directive, des dispositions spéciales étant prises pour assurer la conformité
de l'eau distribuée dans les Etats membres aux paramètres plomb précisés dans l'annexe I.B de la directive.
Le champ d'application de la directive
est extrêmement large puisque sont concernées les eaux de boisson, qu'elles
soient distribuées par un réseau d'adduction ou bien en bouteille (à l'exception
des eaux considérées comme eaux minérales naturelles ou eaux médicinales)
ainsi que les eaux utilisées dans l'industrie alimentaire "sauf s'il peut être établi que l'utilisation
de ces eaux n'affecte pas la salubrité du produit fini" (considérant
n°7).
De plus, la directive pose le principe
selon lequel le respect des valeurs paramétriques doit être assuré au point
où les eaux destinées à la consommation humaine sont mises à la disposition
du consommateur concerné c'est à dire, si besoin est, à la sortie du robinet
(article 6 paragraphe 1, a & considérant
n°21).
Bien plus, la nouveauté de la directive
est d'obliger les Etats, d'une part à prendre les mesures nécessaires pour
déterminer les causes et mettre en place les mesures correctives lorsque les
paramètres définis aux annexes ne peuvent être respectés dans une partie d'un Etat membre et, d'autre part,
permet aux Etats membres d'organiser des dérogations "dans la mesure où aucune dérogation ne constitue un danger potentiel
pour la santé des personnes et où il n'existe pas d'autres moyens raisonnables
de maintenir la distribution des eaux destinées à la consommation humaine
dans le secteur concerné" (article 9, paragraphe 1).
Dans le même temps, la directive fait
obligation aux Etats membres d'instituer toutes les mesures utiles de façon
à ce que l'eau distribuée ou destinée à la consommation humaine ne présente
aucun danger pour la santé, quelle que soit par ailleurs la conformité
de cette eau aux paramètres fixés en annexe de la directive (moins nombreux
que les paramètres fixés par la précédente directive).
Il est prévu à ce titre, lorsqu'un Etat
membre décide d'instituer des paramètres complémentaires à ceux prévus par
les annexes de la directive ou bien de diminuer les valeurs des paramètres
existants dans les maxima admissibles, une procédure d'information de la Commission.
Enfin, la fixation des paramètres est
justifiée par les considérants de la directive, au regard des orientations
de l'Organisation Mondiale de la Santé relatives à la qualité des eaux potables
ainsi que sur l'avis du Comité Scientifique Consultatif de la Commission pour
l'examen de la toxicité et de l'éco-toxicité des composés chimiques.
Par ailleurs, il est rappelé (considérant
n°13) que "les valeurs paramétriques
reposent sur les connaissances scientifiques disponibles et que le principe
de précaution a également été pris en considération ; que ces valeurs ont
été choisies pour garantir que les eaux destinées à la consommation humaine
peuvent être consommées sans danger pendant toute une vie et qu'elles offrent
donc un degré élevé de protection sanitaire".
C'est donc une
directive assez contrastée dont une des caractéristiques est de fixer deux
critères pour qu'une eau puisse être propre à la consommation humaine, d'une
part qu'elle respecte les paramètres fixés en annexe de la directive, d'autre
part qu'elle ne présente aucun danger pour la santé humaine.
Ce second critère englobe d'une certaine
façon le premier puisqu'il est expressément prévu que c'est au regard de la
protection de la santé humaine que sont fixés les paramètres en annexe.
Il convient en outre, de préciser que
deux aspects connexes résultent de modifications législatives récentes en France, à savoir :
-
la
responsabilité du fait des produits défectueux prévue par la loi n°98-389
du 19 mai 1998 insérant les articles 1386-1 à 1386-18 dans le Code Civil,
-
la
loi n°98-535 du 1er juillet 1998 relative au renforcement de la
veille sanitaire et du contrôle de la sécurité sanitaire des produits destinés
à l'homme, modifiant et complétant le livre VIII du Code de la Santé Publique
par un chapitre IX instituant notamment une agence française de sécurité sanitaire
des aliments.
Cette dernière loi a été complétée par
un décret n°99-242 du 26 mars 1999.
En revanche, il ne semble pas que le dispositif
législatif et réglementaire mis en place pour prévenir les risques de saturnisme
ait une incidence directe dans l’immédiat sur les règles relatives à la distribution
de l’eau.
En effet, les décrets du 11 juin 1999
ne concerne que les peintures au plomb, et les poussières qu’elles provoquent.
Ces deux dispositifs ne sont pas sans
incidence sur les régimes de responsabilité en cause du fait de la présence
de nitrate à des teneurs supérieures aux normes admises dans les eaux destinées
à la consommation humaine.
Les règles relatives à la responsabilité,
sur laquelle la directive n’aura semble-t’il qu’un effet indirect, découlent
de deux éléments :
·
Les consommateurs sont dans une relation contractuelle avec
le distributeur
·
La distribution de l’eau est un service public industriel et
commercial assuré par les communes (ou leur délégués).
·
La réglementation européenne laisse aux états membres de l’UE
le pouvoir de fléchir
I Une responsabilité renforcée du producteur
ou du disributeur d’eau
Par la qualification de l’obligation de résultat
Par une nouvelle définition du préjudice
II Une responsabilité potentielle de l’Etat
et des collectivités locales
Par la possibilité de fixer les normes et non de les subir
Par l’obligation de protection de la ressource
Docteur
Roger BATE
European Science and Environment Forum ESEF –
Cambridge – United Kingdom
Connaissances
scientifiques et réglementation : impacts économiques.
Professeur Jean-Jacques DUBY
SUPELEC – GIF sur
Yvette.
Le
principe de précaution et la hiérarchisation des risques ? :
risque
réel et risque négligeable
The definition of a 5 mg/kg
b.w. ADI for sodium nitrate and the consequent regulation of 50 mg/l
maximum content of nitrate in drinking water can be viewed as a perfect case
study for flawed application of the precautionary principle :
-
Poor scientific basis, founded only on animal experiments, with no proposed
physiological explanation of the feared pathogenic process.
-
Lack of scientific ground for extension of animal model to humans, extrapolation
to low doses and safety margins.
-
Lack of any economic factors consideration.
-
Lack of follow up programs for further biological research and epidemiological
studies.
-
Ex post scientific and epidemiological
results not taken into account for later revision of ADI standards and regulations.
-
Generation of public fears by political gesturing and media amplification.
As of today, sodium nitrate
regulations are yet another example of the de
facto irreversibility of precautionary measures.
La
définition de la dose journalière admissible pour le nitrate de sodium, à
5 mg/kg de poids corporel et la norme sur la teneur maximale en nitrate dans
l’eau de boisson qui en découle, fixée à 50 mg/l de NO3-
peuvent être considérées comme un cas d’école de mauvaises pratiques dans
l’application du principe de précaution :
-
bases scientifiques
fragmentaires, sur la seule base d’expérimentations animales,
-
absence d’explication
physiologique du mécanisme pathogène redouté,
-
absence de base scientifique
pour l’extension du modèle animal à l’homme, l’extrapolation pour les faibles
doses et l’établissement de marges de sécurité,
-
absence de considération
pour le moindre facteur économique,
-
absence de programmes
de suivi pour des recherches biologiques complémentaires et pour des études
épidémiologiques,
-
absence de prise en
compte des nouveaux résultats scientifiques et épidémiologiques, pour des
réajustements ultérieurs de la DJA et la réglementation,
-
création d’angoisse
collective à partir de l’attitude des politiques et de l’amplification des
médias.
Jusqu’à
ce jour, la réglementation sur les nitrates est encore une illustration supplémentaire,
de facto, de l’irréversibilité des mesures de précaution.
Monsieur Jean SALMON et Monsieur Louis CAYEUX
FNSEA – Fédération
Nationale des Syndicats Exploitants Agricoles
L'attente
du monde agricole face aux scientifiques et à la réglementation par un responsable
du syndicalisme agricole
Monsieur Eric AVRIL et Monsieur Claude SOCIAS
A.F.O.C. - Association
Force Ouvrière Consommateurs
PARIS
Le
point de vue des consommateurs
Monsieur Dominique BUREAU
Direction des Etudes Economiques de l'Evaluation Environnementale au Ministère
de l'Aménagement du Territoire et de l'Environnement
Efficacité
de la politique Sanitaire et Environnementale
Table ronde
animée par Christophe SIBIEUDE
(Environnement et Technique)
avec :
Professeur Thomas ADDISCOTT, Professeur Marian APFELBAUM,
Professeur Christian CABROL, Professeur Jean-Jacques DUBY, Professeur Maurice
TUBIANA,
Controverse
– opinion publique et connaissance scientifiques ; risques et société
Synthèse et recommandations
M. Josselin De Rohan
Président du Conseil Régional de Bretagne
M. Dominique GARRIGUES
Animateur de la Commission Environnement de
Démocratie Libérale.
M. Claude HURIET
Sénateur de Meurthe et Moselle – Questeur du Sénat
Le
point de vue des politiques : connaissances scientifiques / décisions
DEBAT
Clôture des Assises
Par Monsieur Philippe NOGRIX
Sénateur d'Ille et Vilaine